FISIOLOGIA DE LA GLANDULA TIROIDES.
Las hormonas tiroideas con actividad metabólica sintetizadas son la T4 o tiroxina o tetrayodotironina (en un 93%) y la T3 o triyodotironina (en un 7% del total). Sin embargo la T4 cuando está a nivel plasmático y en casi todos los tejidos sufre una desmonoyodación a nivel del carbono 5´del anillo externo fenólico convirtiéndose en T3, de tal suerte que el 20% de la T3 circulante es sintetizada en la glándula y el 80% restante es producto de la desmonoyodación plasmática y tisular de la T4. Ambas hormonas tienen efectos similares pero la T3 es 50 veces más activa metabólicamente que la T4, pero la T3 tiene una vida media de solo 18 horas comparada con T4 que tienen una vida media de 7 días, por esta razón el tratamiento con L-T4 podría darse una vez a la semana.
En el embrión antes de que las células foliculares inicien la síntesis de hormonas (semana 14 del desarrollo fetal), ésta es suministrada por la madre ya que esta hormona atraviesa la barrera placentaria, lo cual permite el desarrollo fetal antes de esta edad y en los casos de hipotiroidismo congénito lo suple durante todo el desarrollo fetal.
Eje hipotálamo – Hipófisis – Tiroides (HHT).
Para iniciar la descripción de la fisiología de la síntesis de las hormonas tiroideas, debemos iniciar describiendo el eje Hipotálamo – Hipófisis – Tiroides (eje HHT) el cual regula hormonalmente esta síntesis.

1. Hipotálamo:
En las neuronas parvocelulares del núcleo paraventricular se sintetiza una proteína de gran tamaño denominada PreproTRH (prepro hormona liberadora de tirotropina), luego esta por ruptura postraduccional libera un tripéptido formado por Ácido glutámico, Histidina y Prolina que se denomina TRH o hormona liberadora de Tirotropina o Tiroliberina. Estas neuronas del núcleo paraventricular hipotalámico proyectan sus axones a la eminencia media, también del hipotálamo, y acá liberan la TRH. En esta eminencia media la TRH liberada es drenada al sistema porta hipotálamo-hipofisiario para viajar a la adenohipófisis. La síntesis de la preproTRH y la posterior ruptura está activada alostéricamente por niveles bajos de hormonas tiroideas, niveles altos de catecolaminas (en el estrés), neuropéptidos (que se liberan con el frio, siendo el principal estímulo liberador de la TRH) y las leptinas (en estados nutricionales adecuados); por otra parte es inhibida la secreción de la TRH por la hormona somatostatina, por la dopamina a nivel hipotalámico y por niveles altos de HT inhiben la síntesis de la preproTRH.
2. Hipófisis (Adenohipófisis o lóbulo anterior de la hipófisis)
Posee unas células denominadas células tirotropas las cuales poseen receptores para la TRH y tienen por actividad sintetizar y liberar TSH (hormona estimuladora de la tiroides) llamada también tirotropina o tirotrópica, la cual es una glicoproteína compuesta por dos subunidades una α (la cual comparte similitud estructural con la FSH, la LH y hGC ) y otra subunidad β que es la que le confiere la especificidad funcional, o sea que esta subunidad β es la que reconoce el receptor para la TSH en el tirocito (TSHR). Estas células posee receptores para a TRH la cual al actuar como ligando activa el aparato génico de estas células para que sinteticen la subunidad β de la TSH. También estas células tirotropas de la adenohipófisis poseen receptores de las HT las cuales inhiben el aparato génico de estas células para impedir la síntesis de la subunidad β de la TSH. La secreción de TSH posee un ritmo circadiano con pico nocturno antes de dormir y que se ve deprimida con el ayuno y la enfermedad. Los corticoides inhiben la liberación de la TSH.
3. Tiroides:
Los tirocitos poseen en su cara o borde basolateral receptores para la TSH (TSHR), los cuales son receptores trasmembrana tipo serpentina o 7TM o GPCR, receptores acoplados a proteína Gs o sea estimuladora de la adenilciclasa. Cuando la TSH actúa como ligando de sus receptores genera cambios conformacionales en el dominio citoplasmático que hace que se comporte como factor intercambiador de nucleótidos de guanina (GEF) que activan la proteína G acoplada. A concentraciones fisiológicas la TSH es el ligando de receptores TSHR acoplados proteína Gs pero cuando las concentraciones aumentan también se une a TSHR que se encuentran acoplados a proteína Gq. O sea que estos últimos receptores son menos sensibles que los primeros. Lógicamente la activación de una u otra proteína G hace que su fracción α liberada con actividad GTPasa active la proteína con actividad enzimática diana o sea la adenilatociclasa o la fosfolipasa C según sea y por tanto el segundo mensajero sintetizado es diferente, siendo AMPc - PKA en las primeras y IP3 y Calcio en las segundas; aclarando que el principal segundo mensajero es el AMPc. Entonces, en concentraciones fisiológicas de TSH activa la proteína-enzima adenilatociclasa (vía Proteína Gs) catalizando la conversión de ATP en AMPc, el cual es el segundo mensajero (porque la TSH es el primero) que desencadena todo el proceso de señalización celular que permiten la síntesis de las hormonas tiroideas como es la proteogénesis de proteínas que llevan a cabo el proceso de trasporte de ioduros a través de las membranas del tirocito (NIS y pendrina), síntesis de tiroglobulina y síntesis de DEHAL1 (explicadas más adelante). Cuando los niveles de TSH son más elevados utilizando su segundo mensajero IP3 y calcio (vía proteína Gq – fosfolipasa C) se activa la Tiroperoxidasa (TPO) con el fin de llevar a cabo la oxidación y organización de los yuduros (más adelante explicado).
Existe una autorregulación tiroidea cuando los niveles de yodo sanguíneos son muy elevados denominado efecto Wolff-Chaikoff, que consiste en que cuando los niveles de I son elevados estos realizan un bloqueo génico de la síntesis de NIS (ver más adelante) y por tanto se bloque la síntesis de HT (por no ingreso de yoduro al tirocito) impidiendo de esta forma el hipertiroidismo por aporte exagerado de yodo. Este es un proceso reversible, la cual se da dos días después de la normalidad de los niveles séricos de yodo.
Síntesis, almacenamiento y liberación de las hormonas tiroideas.
1.)- Síntesis de la Tiroglobulina (TG).
Las células epiteliales cúbicas que revisten los folículos tiroideos o tirocitos, son las únicas células que poseen los genes que se expresan mediante la proteogénesis en la síntesis de la glicoproteína homodimérica denominada tiroglobulina (TG), la cual posee una cadena polipeptídica de 5.496 aminoácidos, entre los cuales posee 140 residuos de tirosina (tirosilos), y por tanto el aminoácido tirosina es uno de elementos más necesarios para síntesis de las HT junto con el yodo. La síntesis se sucede lógicamente en el RER y la glucosilación se da en el aparato de Golgi, para luego empaquetarse en vesículas que por exocitosis son secretadas al lago coloide del folículo tiroideo; por tanto el coloide del folículo tiroideo está constituido en su mayor parte por esta glicoproteína. Esta glicoproteína tiene por función servir de matriz o molde para la síntesis de las HT y luego para su almacenamiento en forma inactiva, almacenando el 80% del yodo del organismo.
Resumiendo, tenemos entonces que una vez se lleva a cabo la proteogénesis de la TG, luego sufre cambios postraduccionales que se dan el RER (ensamble del homodímero), Aparato de Golgi (glucosilación, incorporación de ácido siálico y sulfatación) y una vez glucosiladas se empaquetan en vesículas exocíticas en el aparato de Golgi para por exocitosis ser liberada al coloide; luego sufre iodinación y multimerización en el lumen folicular para de esta forma participar en la síntesis de las hormonas tiroideas y luego llevar a cabo su almacenamiento en forma inactiva.
La síntesis de la TG y por tanto de las hormonas tiroideas, está estimulada por la TSH hipofisaria, la cual posee receptores trasmembrana acoplados a proteína G localizados en el borde basocelular de los tirocitos (TSHR). Recordemos que ha concentraciones fisiológicas la TSH es el ligando de receptores TSHR acoplados proteína Gs pero cuando las concentraciones aumentan también se une a TSHR que se encuentran acoplados a proteína Gq. O sea que estos últimos receptores son menos sensibles que los primeros. Lógicamente la activación de una u otra proteína G hace que su fracción α liberada con actividad GTPasa active la proteína con actividad enzimática diana o sea la adenilatociclasa o la fosfolipasa C según sea y por tanto el segundo mensajero sintetizado es diferente, siendo AMPc - PKA en las primeras y IP3 y Calcio en las segundas; aclarando que el principal segundo mensajero es el AMPc, pero en última instancia estos segundos mensajeros inducen el dogma central de biología molecular llevando a la síntesis de la TG.
La proteogénesis génica de la TG además de estar inducida por la TSH vía AMPc-PKA, también se induce por la insulina y por el factor de crecimiento tipo insulina 1 (IGF-1).
2.)- Metabolismo del Iodo.
El yodo que se requiere para la síntesis de las HT es de fuente exclusivamente externa, suministrado en la dieta en alimentos:
- Alimentos de origen marino: pescado, mariscos, algas de mar y sal marina.
- Alimentos de origen vegetal: repollo, cebolla, rábanos, nabos verdes, calabaza, champiñones, ajo, frijoles, soya, ajonjolí, espinacas y espárragos.
- Lácteos.
- Huevos
- Alimentos fortificados con yodo: sal yodada, agua, pan, multivitamínicos con yodo, aceite de hígado de bacalao.
En estos alimentos el yodo se encuentra en forma de yoduro de calcio (CaI2) o como yodo inorgánico; este yodo inorgánico resulta de la captura de un electrón por un átomo de yodo o sea que es un anión (ion con carga negativa) y se denomina yoduro con símbolo I-. El yoduro de calcio se convierte en yoduro y junto con el yoduro libre se absorbe en el intestino delgado (yeyuno e íleon) y una vez ingresa vía porta pasa al torrente sanguíneo uniéndose a la albumina para viajar al hígado donde es hidrolizado y liberado como ion yoduro a la circulación con el fin de ir a formar parte de fondo común de yoduro del espacio extracelular, de esta forma está disponible para los tejidos que lo captan; este fondo común de yoduro contiene el yodo proveniente de la dieta pero también está constituido por yodo producto de la desyodación de las HT e incluso por yodo que sale por difusión de la glándula tiroides.
El yoduro localizado en el fondo común de yoduro luego es eliminado en un 90% (4/5 partes) por vía renal y fecal y solo la quinta parte restante es captado por los tejidos que lo requieren para su metabolismo como son:
- Plexos coroides,
- Retina,
- Glándulas salivales,
- Glándula tiroides,
- Glándula mamaria lactante (precisamente para estar el yodo disponible para la lactancia y de esta forma el RN pueda sintetizar sus propias HT).
- Células de la mucosa gástricas y
- Riñón.
En la tiroides logra concentraciones hasta 30 veces superiores a las que se presentan en el plasma.
Los requerimientos diarios mínimos son entere 120 y 200 µgr/día dependiendo si es niños, adultos o embarazada/lactantes, de los cuales 120 µgr son usados por la tiroides y el resto por los otros tejidos que lo usan.
Para la captación del Iodo y luego para ser utilizado por la glándula tiroides se requiere los siguientes pasos:
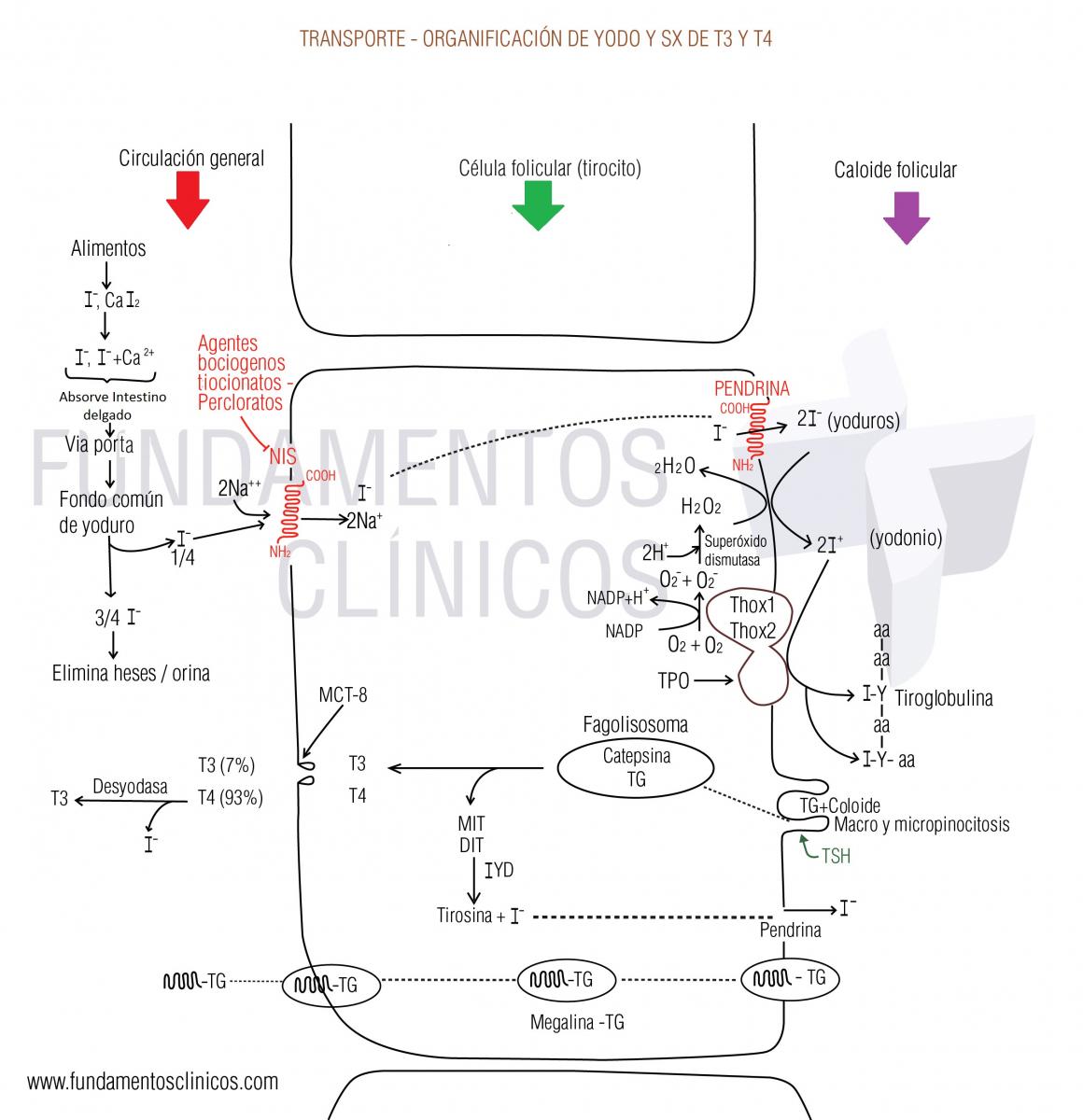
2.1)- Trasporte del yodo hacia el citoplasma del tirocito por la NIS o “bomba de yoduros”. El Iodo ingresa al tirocito (y a los demás tejidos que los capta) mediante un trasporte activo tipo Symport con sodio, lo cual realiza mediante una glucofosfoproteína denominada NIS (Sodium Iodide Symporter) o también llamada “bomba de yoduros”, proteína esta que realiza el ingreso de 2 sodios por trasporte activo a favor del gradiente electroquímico y al mismo tiempo mediante acople trasloca un iodo (2Na+/1I-), en forma de yoduro, también hacia el interior del tirocito, pero este en contra del gradiente electroquímico. Esta glucofosfoproteina se localiza en el borde basocelular del tirocito siendo una proteína con 13 dominios trasmembrana (13TM) con el extremo amino terminal extracelular y el carboxilo intracelular. Los niveles bajos de sodio intracelular del tirocito (que favorecen el trasporte Symporter de la NIS) es dado por la bomba de Na+/K+ ATPasa localizada en el borde basocelular del tirocito.
La expresión génica y la actividad de la NIS está regulada en forma positiva por la TSH, la actividad de la enzima es dependiente de AMPc mediante la fosforilación por la PKA (o sea a través de receptores trasmembrana acoplados a proteína Gs). También la NIS es inducida y activada por niveles bajos de iodo en sangre. Debemos aclarar que las NIS de otros tejidos diferentes al tiroideo no son sensible a TSH.
La expresión génica de la NIS está regulada en forma negativa por niveles altos de iodos plasmática (efecto de Wolf-Chaikoff) y por las citoquinas FNT-α, TGF-β, el IFNϒ, IL1, IL6, glucocorticoides y estradiol.
La NIS es inhibida por los tiocianatos y percloratos y por tanto algunos alimentos que los poseen se denominan bociogénicos, porque dificultan la captación del yoduro, alimentos como la yuca y el repollo que contienen tiocionatos. Otros alimentos bociogénicos pero que no conozco la causa es el maíz, el millo, el bambú y los fríjoles.
2.2)- Trasporte del iodo del citoplasma del tirocito al coloide por la pendrina. El yoduro intracelular de los tirocitos es trasportado al coloide del folículo tiroideo lo cual es llevado a cabo por otra glicoproteína llamada pendrina; proteína localizada en el borde apical del tirocito de 12 dominios trasmembrana (12TM) con los residuos amino y carboxilo terminal localizados en el citosol. Esta proteína trasporta a favor del gradiente de concentración el ion yoduro de la célula epitelial folicular tiroidea al coloide del lumen folicular y también parece trasportar bicarbonato. Debemos referir en este momento que al parecer existen otros canales que también trasportan iones yoduro del citosol del tirocito al coloide diferente a esta proteína pendrina, lo cual se evidencia porque cuando existe mutaciones en esta proteína no se generan cuadros francos de hipotiroidismo. La activación de esta proteína pendrina también es regulada en forma positiva por la TSH vía AMPc (al igual que sucede con la tiroglobulina y la INS)
2.3)- Organificación del yoduro. La organificación del yoduro incluye tres etapas
- Oxidación del yoduro,
- La incorporación del yodo oxidado mediante enlaces covalentes a los residuos tirosilicos de la tiroglobulina,
- Acoplamiento de la monoyodotirosina y la diyodotirosina para formar T3 (triyodotironina) y T4 (tetrayodotironina o tiroxina).
Todas estas tres etapas están catalizadas por otra glicoproteína igualmente sintetizada en el RER de los tirocitos y glucosilada en el aparato de Golgi que se llama Tiroperoxidasa (TPO) o Peroxidasa Tiroidea; la cual una vez sintetizada se localiza en la membrana del borde apical del tirocito ocupando una posición trasmembrana o sea que expresa un dominio citoplasmático, uno intramembrana y otro hacia el lumen folicular. Debido a la localización de la TPO la síntesis de las HT se da en la interface célula – coloide de la membrana apical del tirocito.
Esta TPO es un complejo enzimático formado por 3 proteínas:
- Proteínas-enzimas NADPH oxidasas (DUOX1 y DUOX2) generadora de H2O2,
- Oxidasa de iones yoduro, y
- Trasportadora de yodo.
2.3.a).- Oxidación del yoduro: Una vez los iones yoduro se localizan en la cara externa del borde apical del tirocito dentro del coloide deben ser oxidados, oxidación que se realiza dependiente de peróxido de hidrógeno. La disponibilidad del H2O2 es responsabilidad de la TPO mediante su fracción oxidasas tiroideas 1 (ThOX1) y 2 (ThOX2) y que ahora se les llama DUOX1 y DUOX2, la cual es una flavoproteina NADPH dependiente que se encuentra unida a la membrana apical del tirocito, la cual es muy parecida a la NADPH Oxidasa responsable del estallido respiratorio de algunos leucocitos. VER GRAFICO 116 CUADERNO HELM2. Luego el mecanismo de acción de estas oxidasas tiroideas consiste catalizar la reacción para la formación del anión superóxido (O2-) a partir del oxígeno de la respiración, al cual se le agrega un electrón donado por el NADPH; luego de formado el radical libre superóxido se lleva a cabo la dismutación (catalizado por la enzima superoxido dismutasa) por aporte de protones aportados por hidrogeniones (H+) formándose el peróxido de hidrógeno (H2O2).
Con el H2O2 disponible entra en escena la Tiroperoxidasa quien utilizando dos iones yoduro, dos hidrogeniones y una molécula de H2O2, para formar yodo oxidado o iones yodonio (I+) y agua.
2 I - + H2O2 + 2H+ Tiroperoxidasa→ 2I+ + 2 H2O
Debido a que puede haber exceso en la producción de H2O2 el tirocito posee las enzimas glutatión peroxidasa y tiorredoxin reductasa con el fin de protegerse de la toxicidad del H2O2.
2.3.b).- La incorporación del yodo oxidado mediante enlaces covalentes a los residuos tirosilicos de la tiroglobulina: Solo unos 40 residuos tirosilos de los 140 residuos que posee la TG, realizan enlaces covalentes con el yodo y estas zonas de la proteína se denomina zonas hormonogénicas. Esta incorporación del yodo a la TG también es catalizada por la enzima TPO uniendo un yodo al carbón 3 de un resido de tirosina de la TG formando el monoyodotirosina (MIT) o uniendo uno al 3 y otro al 5 formando la diyodotirosina (DIT) las cuales no son hormonas activas metabólicamente y se les denomina tirosinas o iodotirosinas.
2.3.c).- Acoplamiento de la monoyodotirosina y la diyodotirosina para formar T3 y T4. Los residuos de tirosina que fueron yodados son alineados en lados opuestos en reacción catalizada igualmente por la TPO con la salida de una alanina y la formación de la T3 si se alinea una MIT con una DIT o de T4 si se alinea dos DIT. En el 99% de los casos se alinea en forma de T4, almacenando cada molécula de TG hasta 8 residuos de T4.
3.)- Almacenamiento y liberación de las HT.
Una vez acoplados los residuos de tirosina yodados en forma de T3 y T4 y los MIT y DIT, se almacenan en el coloide del folículo tiroideo formando parte de la molécula de tiroglobulina. Recordemos que el depósito de T3 y T4 es suficiente para los requerimientos hormonales de todo el cuerpo durante 30 días y que el yodo almacenado en el coloide corresponde al 80% de todo el yodo del organismo.
La liberación de las HT se lleva a cabo en tres pasos: a) Endocitosis de coloide por los tirocitos, b) Proteólisis de la TG en los lisosomas y c) Secreción de las HT a la circulación general.
3.a).- Endocitosis de coloide por los tirocitos: Este proceso es liderado e inducido por la TSH la cual induce la formación de seudópodos en el borde apical que lleva a cabo la endocitosis de gotas de coloide lo cual se denomina macropinocitosis y también por la formación de pequeñas vesículas en el borde apical lo cual se llama micropinocitosis. Uno y otro proceso (siendo la micropinocitosis el predominante en el ser humano) tiene como efecto neto la captura de coloide con TG.
3.b).- Proteólisis de la TG en los lisosomas: Luego las vesículas endocitadas se fusionan con los lisosomas del tirocito formando el fagolisosoma, el cual se desplaza al borde basolateral del tirocito. Dentro de este fagolisosoma se encuentran enzimas endopeptidasas como la catepsina la cual causa la proteólisis aminoácido por aminoácido y rompiendo los enlaces peptídicos que mantenía unidas las T3, T4, MIT y DIT liberándolas.
3.c).- Secreción de las HT a la circulación general. La T3 y T4 liberadas por la catepsina son traslocadas a la circulación general al parecer por unos transportadores de aminoácidos o monocarboxilatos – 8 (MCT-8) a través de la zona basal de tirocito. La T4 se libera en mucha mayor cantidad que la T3 (llegando a ser hasta 80 mcgr/día). Los MIT y DIT liberados permanecen en el citoplasma del tirocito y debido a que son inactivas biológicamente y que tampoco pueden ser recicladas e incorporadas en esta forma a la Tiroglobulina con el fin de sintetizar hormonas, deben ser deiodadas con la liberación de iodo y tirosina, lo cual es llevado a cabo por la enzima yodo tirosina deshalogenasa tipo 1 (DEHAL1) o llamada también yodo tirosina desyodinasa (IYD), ahora si este yoduro y esta tirosina liberada pueden ser nuevamente reutilizadas en la hormonogenesis. La MIT y DIT contienen las 2/3 del iodo que posee una molécula de TG o sea que el iodo de la T3 y T4 es solo 1/3 del iodo que posee la TG. Esta enzima también hace parte de las NADPH oxidasas/flavino reductasas.
No toda la TG es degrada a nivel del tirocito para liberar la T3, T4, DIT y MIT, sino que cerca del 10% se libera a la circulación general (junto con los hormonas que contiene), lo cual sucede debido a que a nivel del borde apical existe unas lipoproteínas denominadas megalina, la cual actúan como receptores endocíticos de la TG del coloide. Esta TG “internalizada” por la megalina se “salta” la proteólisis lisosomial y en lugar de esto es trasportada a la cara basolateral del tirocito atravesándola y migrando al plasma (incluso con la proteína megalina unida a ella), luego el plasma es desiodada pero por enzimas halogenasas diferentes a las que actúan en el lisosoma del tirocito. El yodo liberado va a ser parte del fondo común de yoduro.
Trasporte de las hormonas tiroideas a nivel plasmático y a través de las membranas celulares de las células diana.
Una vez que son liberadas al torrente circulatorio las HT se unen a proteínas albúmina y globulina, siendo la forma que queda libre de las hormonas la forma activa que se unen a los receptores celulares. El 99.97% de la T4 se une a las proteínas en una proporción del 75% a la globulina transportadora de tiroxina (TBG Thyroxyne – Bilding - Globulin), un 15% a la prealbúmina o transtiretina (TTR) y el resto a la albúmina (cerca del 10%) quedando solo el 0.03% en forma libre. En el caso de la T3 se une a las proteínas el 99.7% de la hormona sintetizada lo cual lo hace en 80% a TBG y el resto a la albúmina, siendo el trasporte por la prealbúmina (TTR) de casi de cero, por lo cual la fracción libre de T3 es del 0.3% del total de la hormona sintetizada. Estas proteínas son sintetizadas en el hígado y sus alteraciones en la síntesis causan lógicamente aumento o disminución de sus concentraciones pero su aumento, disminución o ausencia no afecta los niveles de HT libres. Como dato metabólico mencionamos que las HDL contienen dentro de sus proteínas a la TBG, la transtiretina y la albúmina, las cuales trasportan aproximadamente el 3% de la T4 y el 6% de la T3.
Para el ingreso a las células de los tejido diana de estas hormonas, antes se consideraba que debido a que estas hormonas son lipofílicas, atraviesan las membranas celulares con facilidad aún de manera pasiva, pero hoy se sabe que requieren trasportadores estereolectivos para T3 y T4 que se expresan selectivamente en unos tejidos. Luego que ingresan a la célula deben ingresar al núcleo de la misma con el fin de actuar como ligando de receptores para T3 nucleares.
Las trasportadoras de HT a nivel de membranas plasmáticas son de dos tipos:
|
Proteínas de transporte de aniones orgánicos (PTAO) entre las que tenemos por ejemplo: PTAO1B1, PTAO1B2 y PTAO1B3: Se expresan en hígado y tienen igual afinidad por T3 y T4. PTAO1C1: se expresa en cerebro, testículo y cóclea, tiene mayor afinidad por T4 y T3r que por T3 |
|
Proteínas trasportadoras de aminoácidos o monocarboxilatos (MCT-8) |
Además una vez dentro del citosol poseen proteínas de unión citosólicas a T3 que tienen importancia en la homeostasis de las HT en la célula.
Mecanismo de acción de las hormonas tiroideas.
Las HT tienen dos mecanismos de acción unos genómicos y otros no genómicos.
Mecanismos de acción genómicos:
Este mecanismo se activa cuando las HT ingresan al núcleo de la célula diana y actúa como ligando de unos receptores para estas hormonas denominados receptores de hormonas tiroideas (TR) los cuales son exclusivamente para la T3, por cuanto la T4 no posee receptores; receptores estos que son de la misma familia de los receptores para hormonas esteroideas, para los retinoides y para la vitamina D3. De estos receptores dependiendo la célula en que se exprese existen varias isoformas (como los receptores adrenérgicos) TRα1, TRα2, TRβ1, TRβ2 y TRβ3 teniendo la T3 una afinidad 50 veces mayor que la T4, por eso se considera a la T3 como la forma activa a nivel nuclear; por ejemplo TRα1 se expresa a nivel cardiovascular aumentando el gasto cardiaco (inotropismo y cronotropismo positivo + disminución de la RVP), también está presente en músculo esquelético y grasa parda; los TRβ1 predominan en cerebro, hígado y riñones y el TRβ2 predomina en hipotálamo e hipófisis.
Estos receptores de hormonas tiroideas (TR) cuando no tienen unido el ligando (HT) tienen una intensa actividad represora de la expresión de genes localizados sobre zonas del ADN que se denominan elementos de respuesta a T3. Cuando la HT actúan como ligando sobre estos TR anula la represión que ejercía el TR y además activa la expresión del gen que se encontraba reprimido. Para llevar a cabo su actividad estos receptores poseen un dominio que se une a la HT y otro dominio que se une a los elementos de respuesta a T3 del ADN.
Una de las actividades genómicas en todas las células consiste en la expresión del gen que codifica para la bomba de Na+/K+ ATPasa y por tanto aumentando su expresión en la membrana celular de todas las células diana, esto explica porque en el hipertiroidismo la hiperactividad de esta función lleva como consecuencia a que se necesite más ATP para el funcionamiento de la gran cantidad de bombas que se poseen y en consecuencia se incrementa el consumo de oxígeno y por tanto del metabolismo basal.
Mecanismos de acción NO genómicos:
Este mecanismo de acción aún no se encuentra bien dilucidado, pero se relaciona con la regulación a nivel de la membrana celular, de las mitocondrias y del citosol de las células diana.
A nivel de la membrana celular las HT realizan una importante regulación en el trasporte trasmembrana de Na+, K+, Ca+2, Glucosa y de proteínas. A nivel citosólico regulan la actividad de importantísimas proteínas cinasas como la PKA, PKC, MAPK y la ERK.
Esta actividad no genómica a nivel cardiaco tiene grandes implicaciones pues activa la bomba de Ca+2 ATPasa de la membrana plasmática y el R. sarcoplasmático, activa la bomba Na+/K+ ATPasa, del antitrasporte Na+/H+ y de la corriente rectificadora de K+, además que coexitan los receptores β adrenérgicos, todo lo cual como vemos lleva a un aumento de la actividad cardiaca.
A nivel de mitocondrias tenemos receptores para T3 los cuales interactúan con proteínas desacoplantes de la cadena trasportadora de electrones (con aumento de la producción de calor) y también activa una proteína que trasloca ADP del citosol a la matriz mitocondrial (llamada adeninonucleotidotraslocasa) lo cual activa alostéricamente el ciclo de Krebs con el incremento de la síntesis de ATP. También se conoce la relación con la activación del gen mitocondrial que codifica para el citocromo c oxidasa de la cadena respiratoria llevando a una mayor actividad. Vemos entonces que la actividad no genómica sobre la mitocondria lleva a un mayor consumo de oxígeno con aumento del metabolismo basal.
Actividad biológica de las hormonas tiroideas (efectos fisiológicos).
Estas hormonas mediante su mecanismo de acción EJERCEN ACCIÓN SOBRE CASI TODOS LOS TEJIDOS Y SISTEMAS y por eso describir los efectos fisiológicos a consecuencia de su mecanismo de acción es casi imposible, sin embargo realizo un listado de las principales, más conocidas y más espectaculares acciones biológicas de las HT:
.- Desarrollo y maduración del SNC:
- Necesarias para la proliferación, migración, arborización y expresión de marcadores de las neuronas, en la génesis de la sinapsis y reciclado de neurotransmisores. Esta intervención se da durante la vida intrauterina y hasta los 2 años de vida; por eso su deficiencia en el hipotiroidismo congénito causa el cretinismo (retardo mental).
- Activa a nivel genómico el gen que codifica para la síntesis de hormona del crecimiento (GH) y hormonas gonadotróficas. Por eso en el hipotiroidismo congénito causa enanismo.
.- Efectos metabólicos:
- Incrementa el metabolismo basal (ya explicado), en ausencia de la tiroides el metabolismo basal caería más del 50% de su valor normal.
- Incrementa la tasa de ventilación por requerirse mayor consumo de O2 a nivel del metabolismo aeróbico.
- Incrementa el metabolismo de proteínas y carbohidratos por aumento del metabolismo basal.
- Activa a nivel genómico el gen que codifica para la síntesis del receptor de la proteína APOB100 presente en las lipoproteínas LDL, receptor presente en las células esterogénicas y los hepatocitos.
- Aumento de velocidad del tránsito intestinal.
- Aumento de la secreción de gástrica (asociada hiperorexia).
- Disminución de la absorción de lípidos a nivel TGI.
- Regula la mineralización ósea.
.- Efectos hemodinámicos:
- Incrementa el gasto cardiaco por aumento de la FC, el inotropismo y disminución de la RVP (ya explicado).
- Aumenta el número de receptores de catecolaminas y amplifica la respuesta postreceptor en el sistema simpático.
- Aumenta la eritropoyetina.
.- Efectos Termogénesis:
- Generación de calor en todos los tejidos menos en el cerebro (incluida la adenohipófisis), Útero, ganglios linfáticos y testículos, por el desacoplamiento de la cadena trasportadora de electrones.
Catabolismo de las hormonas tiroideas.
El catabolismo de las HT se da por desyodación, descarboxilación, desaminación, sulfatación y glucoronidación.
Desyodación: Es el principal mecanismo de desactivación de las HT lo cual es catalizado por las enzimas denominadas desyodasas de las que se conocen tres isoformas la D1, D2 y D3. Esta enzima es una seleno-depediente o sea que posee un grupo de selenio unido a una serina (selenio-serina) la cual realiza desyodaciones sucesivas hasta formar tironina T0, la cual carece de yodo. Pero tengamos en cuenta que la desyodasa no solo lleva a catabolismo de las HT sino que es mecanismo más importante para la formación de T3 a partir de la desyodación del átomo de yodo localizado en el carbono 5´ del anillo externo fenólico de la T4, lo cual se sucede a nivel de casi todos los tejidos y del plasma y por tanto es la fuente principal de T3 activo metabólicamente, la enzima que cataliza esta desyodación en este carbono se denomina precisamente 5´desyodasa. Debido a que la desmonoyodación de la T4 a T3 se da en las células de acuerdo a los requerimientos hormonales que posea, cuando las necesidades metabólicas están cubiertas la monodesyodación se lleva a cabo en el carbono 5 del anillo interno tirosílico formándose ahora la T3 reversa o inversa (T3r) la cual es un metabolito inactivo metabólicamente, siendo el inicio del metabolismo de la T4 sin paso por T3.
Descarboxilacion y desaminación: Solo metaboliza el 5% de las HT y por esta vía se obtiene la tetrayodotiroacético a partir de la T4 y la triyodotitoacético a partir de T3.
Sulfatación o glucoronidación: Lo cual se realiza al conjugarse con sulfato o con ácido glucurónico a nivel del grupo hidroxilo del anillo externo fenólico.
EXAMENES DE LABORATORIO DE PERFIL TIROIDEO.
Aporte diario normal de yodo: en niños de 90-120 µgr/día, para adultos 150 µgr/día y para embarazadas y lactantes debe ser de 200 µgr/día
Yodo en sangre = 5 -10 µgr/dL
Yodo en orina = ≥ 10 µgr/dL
TSH = 0.4 a 4 mUI/L
T4 Total = 5 – 13 µg/dL
T4 Libre mujeres = 0,81 – 1,52 ng/dL
T4 Libre hombres = 0,90 – 1,53 ng/dL
T3 Total = 80 – 200 ng/dL
T3 Libre = 1.5 – 4,5 pg/dL
T3 reversa = 10-50 ng/dL
Tiroglobulina. = 5 – 25 µgr/L (5 - 25 ng/ml)
Tiroglobulina. = < 6,5 µgr/L (6,5 ng/ml) en atiroideo
Ac AbTG = menos de 18 UI/L
Ac AbTPO = menos de 15 UI/L
Ac AbTSHR = menos de 10 UI/L
CORELACIONES CLINICAS DE LA TIROIDES Y HORMONAS TIROIDEAS.
En otras hojas de este sitio encontramos el estudio de las patologías de la tiroides así como las relacionadas con las hormonas tiroideas y por tanto en este momento solor realizaremos una breve pero clara definición de estas patologías con el fin de que podamos entenderlos cuando los mencionemos:
Bocio: Es todo aumento de tamaño de la glándula tiroides ocasionado por factores tróficos externos o internos que llevan a hiperplasia (génesis de nuevos tirocitos y folículos tiroideos) y/o hipertrofia de los tirocitos (crecimiento a despensa de los tirocitos), quedando expresamente excluidas las tiroiditis y los tumores tanto benignos como los malignos, a pesar que etimológicamente la palabra bocio provenga del latín “bocius”, que quiere decir “tumor”.
Tiroiditis: Es la inflamación de la glándula tiroides, (lo que puede aumentar su tamaño pero no se llama bocio), inflamación que pude ser de causa infecciona bacteriana o viral, casusa inmunológica, por radiaciones, traumática o iatrogénica.
Nódulo o adenoma tiroideo: Son tumores benignos de la glándula tiroides que pueden ser funcionantes o no y que pueden ocasionar el aumento del tamaño de la glándula sin que sean incluidos entre las causas de bocio.
Hipotiroidismo: Conjunto de manifestaciones clínicas debido deficiente actividad de las hormonas tiroideas.
Hipertiroidismo: Conjunto de manifestaciones clínicas debido a la excesiva concentración de hormonas tiroideas que son producidas exclusivamente por una hiperfunción o aumento de actividad de la glándula tiroides.
Tirotoxicosis: Conjunto de manifestaciones clínicas debido a la excesiva concentración de hormonas tiroideas de cualquier origen sea por un hipertiroidismo o de otro origen como por ejemplo la destrucción de la glándula o por suministro de L-T4 en exceso.
Fenómeno de Job-Basedow: El fenómeno de Job-Basedow se presenta en dos situaciones, la primera cuando los tirocitos poseen valores bajos de yodo por escaso suministro y son expuestos en forma aguda a altas dosis de yodo (como por ejemplo al suministrar medios de contraste yodados) esto desencadena un aumento significativo de la producción de HT llevando a hipertiroidismo y tirotoxicosis, esto parece explicarse por la rápida yodación de Tiroglobulina pobremente yodada. La segunda situación por la que se presenta el fenómeno de Job-Basedow se debe precisamente a la presencia de tejido tiroideo con funcionamiento autónomo como es el caso de los bocios multinodulares funcionantes. Aclaramos que este fenómeno de Job-Basedow no se presenta en pacientes que posean niveles de yodo normales con función tiroidea normal, independientemente de la dosis de yodo suministrada, porque son protegidos por el efecto de Wolff-Chaikoff, fenómeno que podría en forma simplista considerarse el contrario al de Job-Basedow.
CORRELACIONES CLÍNICAS DE ERRORES INNATOS EN LA SÍNTESIS DE HT.
Deficiencia en la proteína NIS: alteración congénita que causa un déficit en la captación de yodo por el tirocito, el tratamiento es con la administración de yodo en altas dosis.
El error innato por deficiencia de la TPO: lo cual se manifiesta porque se impide la oxidación del yodo, el tratamiento es con la administración de T4.
La inhibición de la organificación del yodo es utilizado por algunos medicamentos antitiroideos como el metimazol, tiourea y tiouracilo.
El error congénito en el acoplamiento de las yodotironinas: se trata con la administración de T4.
El defecto en la desyodasa: enzima que permite la reutilización de la tirosina y el yodo producto de la acción de la enzima sobre el MIT y DIT, causa la eliminación de estas moléculas vía renal con la consiguiente pérdida de yodo, cuyo tratamiento es agregar yodo.
