NODULO TIROIDEO (NT)
DEFINICION:
Es una lesión discreta dentro de la glándula tiroidea formado por tirocitos, que se diferencia radiológicamente del parénquima tiroideo vecino (1), con tamaño que puede variar desde mm hasta grandes masas de 8 a 10 cm de diámetro.
Cuando una lesión palpable no se evidencia radiológicamente, ésta lesión no corresponde a la definición de nódulo tiroideo. Pero el caso contrario, si corresponde a la definición o sea que se evidencia imagenológicamente (US, TC, RM o PET) pero no es palpable y se denomina “incidentaloma” (2). Los nódulos no palpables tienen el mismo riesgo de malignidad que los palpables, del mismo tamaño.
El bocio multinodular (BMN) no tóxico o simple o coloide, no es un bocio que posee múltiples adenomas tiroideos, sino que es un estado evolutivo de un bocio difuso no tóxico o simple o coloide de larga data, que aparece debido por la diferencia en la respuesta de las células foliculares del bocio difuso simple a estímulos externos de las hormonas tróficas. Sin embargo si algún tirocito tiene una ventaja de crecimiento dado por alguna anomalía genética (similares a las que causan los adenomas tiroideos solitarios), puede originar un clon de células proliferativas que da origen a un adenoma o nódulo dominantes del BMN con funcionamiento autónomo. Por lo tanto en un BMN pueden coexistir un nódulo monoclonal (consecuencia de una mutación) y nódulos policlonales (consecuencia de la respuesta diferencial de los tirocitos a estímulos tróficos).(3)
EPIDEMIOLOGIA DE LOS NÓDULOS TIROIDEOS:
La prevalencia de nódulos palpables en sitios con buen aporte de yodo es del 5% en mujeres y del 1% en hombres (1).
En el estudio Framingham (Massachusetts) llevado a cabo durante 15 años, se evidenció que la enfermedad nodular se presenta en el 6,4% las mujeres y el 1,5% de los hombres entre los 30 y 59 años de edad. (4)
Por US se detectan nódulos en el 19 a 68% de los casos, (1) o sea que el uso de la ecografía aumenta la posibilidad de descubrir nódulos tiroideos entre un 19 y 69%, por lo cual no está indicado el screening de US tiroidea.
En forma general el riesgo de cáncer de los nódulos tiroideos es del 7 al 15% (1), aumentándose el riesgo al 30% en las personas que han recibido radiación en cuello (2)
Cuando en el bocio multinodular (BMN) existe un nódulo dominante, éste tiene similar posibilidad de malignidad que el nódulo solitario, por lo que debe ser estudiado igual.
Los nódulos tiroideos autónomos constituyen del 5 al 10% de los NT palpables y tienen menos posibilidad de albergar un cáncer tiroideo, solo es del 0,2 a 0,5%.
El cáncer diferenciado de tiroides (CDT) representa el 90% del canceres de los nódulos tiroideos. (1)
Los nódulos múltiples (bocio multinodular – BMN) son 3 veces más frecuente que los nódulos solitarios; sin embargo, los nódulos palpable son 3 veces más comunes en los NS que los BMN. (2)
La prevalencia de la enfermedad nodular se aumenta en un 20 a 50% en las personas que han recibido radiación ionizante con una dosis de absorción en cuello mayor a 5 Gy. (5)
Es más frecuente el NS en jóvenes, mientras que la presencia de un nódulo dominante en un BMN es más frecuente en personas añosas. (2)
Más frecuente en áreas deficientes de yodo.
La prevalencia de nódulos tiroideos en necropsias es del 50% de la población general. (6)
ETIOLOGÍA DE LOS NÓDULOS TIROIDEOS (NT):
Tiene estrecha relación con la población añosa y en áreas deficientes de yodo.
Probablemente los NT se originan de un pequeño grupo de tirocitos o de pronto de un solo tirocito, que bien sea desde el desarrollo embrionario o por una mutación de novo, pierde el control regulador que posee la TSH sobre éstas y empieza a dividirse en forma autónoma y a una ritmo diferente de las demás tirocitos.(7)
Entre los factores de riesgo que conducen al desarrollo de nódulos tiroideos se encuentran: (5)
- Radiación ionizante.
- Tabaquismo.
- Consumo de alcohol.
- Obesidad.
- Sd. metabólico.
- Fibrosis uterina.
- Aumento de niveles de IGF-Tipo 1.
Entre factores protectores se consideran: (5)
- Anticonceptivos orales.
- Estatinas.
HISTOPATOLOGÍA DE LOS NÓDULOS TIROIDEOS (NT): (3) (8)
Desde el punto de vista histopatológico los NT se clasifican en:
- Nódulos quísticos verdaderos o quiste simple verdadero.
- Nódulos coloides.
- Nódulos tiroideos mixtos o complejos.
- Nódulos tiroideos sólidos.
1).- Nódulo tiroideo quístico verdadero o quiste simple verdadero:
Corresponde a un quiste en el tiroides que está revestido de células epiteliales foliculares normales, los cuales son muy raros, entre los que se tienen:
- Quiste tirogloso dentro del tiroides: remante embriológico.
- Quiste hidatídico o echinococcico (muy raro): por el parásito Echinococcus.
- Higroma quístico: malformación linfática.
- Quiste branquial: remante de la 1, 2 o 3 bolsa faríngea.
2).- Nódulos coloides.(8)
Los nódulos coloides se caracterizan porque no poseen cápsula sino que está limitado por células epiteliales foliculares y pueden ser:
- Nódulo coloide macrofolicular o tipo 1.
- Nódulo coloide hiperplásico o tipo 2.
- Nódulo coloide trabeculado o tipo 3.
El nódulo coloide macrofolicular (o tipo 1) corresponde histológicamente a un quiste sin cápsula formado por un macrofolículo tiroideo de 1 a 15 mm de diámetro, el cual tiene un riesgo de malignidad del 0%.
Ecográficamente son anecoicos con puntos hiperecogénicos en sus paredes (spots) con artefacto de “cola de cometa” que corresponde a “coloide denso” formados por detritos de cristales de oxalato de calcio y colesterol (se deben diferenciar de las microcalcificaciones, las cuales producen artefacto de “sombra acústica posterior”).
El nódulos coloides hiperplásico (o tipo 2) o espongiforme, corresponde histológicamente a un quiste macrofolicular sin cápsula, que posee un epitelio aplanado folicular hiperplásico con papilas o pseudopapilas que se proyectan hacia la zona quística, dándole un aspecto de “rejilla” o “panal de abejas” o “honeycomb” en inglés, el cual también tiene un riesgo de malignidad del 0%.
Ecográficamente es isoecogénico, también tiene los spots hiperecogénicos en sus paredes con artefacto de “cola de cometa”. Al Doppler color es hipervascularizado.
Nódulos coloides trabeculado (o tipo 3), corresponde histológicamente a un quiste macrofolicular sin cápsula (o incompleta) que posee tabiques gruesos (trabeculaciones) en forma irregular, el cual posee un riesgo de malignidad del 1.5%.
Ecográficamente es isoecogénico, dada por la porción sólida de las trabeculaciones, con vascularización al Doppler color. También posee los spots hiperecogénicos en sus paredes.
3).- Nódulos mixtos o complejos:
Son adenomas tiroideos sólidos que han sufrido degeneración quística, por lo general funcionantes (es más raro que se presente en los no funcionantes). Tienen el mismo riesgo de malignidad de un nódulo sólido, pero disminuyendo la probabilidad a medida que aumenta la proporción quística del nódulo (9), porque es el componente sólido es el que da el riesgo, lo cual puede ser solo un engrosamiento de la pared del nódulo o una masa de células en la pared o una gran parte del nódulo.
4).- Nódulo tiroideos sólidos:
Los cuales pueden ser benignos o malignos.
4.1).- Nódulos tiroideos neoplásico benigno o neoplasia folicular o adenomas microfoliculares. (3)
Histológicamente son lesiones sólidas, bien delimitadas porque siempre tienen una capsula bien formada e intacta (no la invade) que recubre todo el tumor, donde las células epiteliales o tirocitos que lo forman se organizan formando folículos bien diferenciados muy pequeños que contienen coloide (similares a los del parénquima tiroideo normal) por eso se llama microfolicular. La cápsula es de tejido fibroso, la cual por lo general no permite el paso de los vasos sanguíneos sino que se localizan rodeando la cápsula, por tanto la vascularización es perinodular, lo cual hace que la vascularización en la parte central del nódulo es escasa y esto hace que cuando aumenta de tamaño tiende a necrosarse en el centro (por esta razón un adenoma microfolicular funcionante puede estar en crecimiento pero sin toxicidad), o a presentar zonas hemorrágicas (lo cual causa dolor) que dan origen zonas de fibrosis, formación de calcificaciones y cambios quísticos. Las células epiteliales o tirocitos o células foliculares que lo forman tienen muy poca variación morfológica y las formas mitóticas son infrecuentes, en esto se diferencian histológicamente del cáncer (que si tiene formas mitóticas extensas con gran celularidad). En ocasiones las células epiteliales que lo forman tienen abundante citoplasma eosinófilo con núcleos pequeños regulares (cambios oxifilo u oncocíticos) las cuales se llaman células de Hürthle y entonces se llamará Adenoma con células de Hürthle.
Ultrasonográficamente son isoecogénicos o hiperecogénicos, con o sin calcificaciones (que poseen artefacto de sombra acústica posterior), con vascularización periférica clasificación Lagalla modificada Chamams 2005 tipo II o IIIA, que se denomina ecográficamente como halo perinodular, con tamaño en promedio al momento del diagnóstico de 3 cm pero pueden ser muy grandes como de 10 cm (por eso comprimen en parénquima adyacente). Riesgo de malignidad: 10%.
Desde el punto de vista funcional los adenomas microfoliculares o neoplasias foliculares pueden ser funcionante o no funcionante. Los funcionantes no tiene regulación por la TSH, por mutación de la subunidad α de la proteína Gs ligada al TSHR o por mutación en el mismo receptor y por esto se les denominan nódulos o adenoma tiroideo autónomo y cuando da síntoma de tirotoxicosis se denomina adenoma autónomo tóxico; estas mutaciones son muy infrecuentes en los carcinomas de tiroides (por lo cual los nódulos tóxicos no son precursores de cáncer de tiroides). Los adenoma no funcionantes en un porcentaje <20% tienen la mutación de RAS (10) (subunidad fosfatidil inositol 3 Kinasa – PIK3CA) y portan gen de fusión PAX8-PPARG) (11), lo cual les da el riesgo de malignidad.
4.2).- Nódulo neoplásico maligno:
Histológicamente no tienen capsula o es incompleta, donde las células cancerígenas invaden la cápsula o la vasculatura.
Ultrasonográficamnte son hipoecogénico, con o sin macro o microcalcificaciones (que poseen artefacto de sombra acústica posterior) que pueden corresponder a cuerpos de psammoma, con vascularización clasificación Lagalla modificada Chamams 2005 tipo IIIB, IV o V.
Entre los NS el 5% son adenomas autónomos hiperfuncionantes tóxico o no tóxico (gammagráficamente hipercaptantes), el 10% son adenomas autónomos normofuncionantes (gammagráficamente isocaptantes) y el 85% son adenomas no funcionantes (gammagráficamente hipocaptantes). (2)
En el estudio de Hamburger, en el cual siguió pacientes por 6 años, evidenció que los NS autónomos hiperfuncionantes no tóxicos > a 3 cm, al momento del diagnóstico, evolucionan a NS tóxico en un 20% de los casos, mientras que los menores de este tamaño lo hacen solo en el 2 al 5% de los casos. (12)
En el estudio Kunma, donde se siguieron paciente con NT por 9 a 11 años, se evidenció que el 13% de los pacientes reducían el tamaño del NT, el 23% aumentaba el tamaño, el 34% no modificaba el tamaño y el 30% ya no era palpable el NT. (13)
DIAGNOSTICO DE NODULOS TIROIDEOS:
Los nódulos < 1 cm solo se deben evaluar si tienen manifestaciones clínicas o se asocian a adenopatías, mientras que los > 1 cm se deben evaluar (1).
1).- Historia clínica:
1.1).- Anamnesis (MC + EA):
.- Asintomáticos de crecimiento lento e indoloro, la mayoría.
.- Síntomas compresivos: (Factor de riesgo clínico para malignidad).
- Disfonía: por compresión del nervio recurrente laríngeo.
- Disfagia: por compresión del esófago.
- Disnea: por compresión de la tráquea.
.- Síntomas de HPeT, cuando es un nódulo caliente inhibidor tóxico (nódulo tóxico).
.- En muy raros casos:
- Sd. Horner: por compresión de la cadena ganglionar simpática torácica.
- Parálisis del nervio frénico.
- Maniobra de Pemberton positiva: Se presenta en bocios muy grandes por NT en los cuales al extender los brazos sobre la cabeza causa que el bocio descienda por el opérculo torácico y esto lleva a signos obstructivos por compresión de la tráquea (disnea) y compresión del paquete vásculo-nervioso del cuello (vena yugular interna o incluso la subclavia o la cava superior), llevando a ingurgitación yugular, plétora facial e incluso síncope.
1.2).- Antecedentes: Factores de riesgo clínico para malignidad de un nódulo tiroideo:
.- Nódulo con alta sospecha:
- Antecedente familiar de cáncer tiroideo o NEM2.
- Nódulo de aparición reciente, crecimiento rápido e indoloro.
- Nódulo sea fijo y duro (pétreo).
- Glándula tiroides fija (no se moviliza con la deglución).
- Adenomegalias no reactivas (no dolorosa, fija, indurada, unilateral, principalmente en niveles III, IV, V y VI)
.- Nódulo con moderada sospecha:
- Género masculino.
- Edad < 20 años y > 60 años.
- Antecedentes de radioterapia en cabeza y cuello o radiación por accidentes radiactivos.
- Síntomas compresivos (disfonía, disfagia, disnea)
- Nódulo a la palpación > 4 cm.
.- Nódulo con baja sospecha:
- Todos los demás.
1.3).- Examen físico:
La palpación de la tiroides se debe realizar desde aproximación posterior con cuello en ligera hiperextensión, pero la palpación del NT depende de la anatomía del cuello del paciente y de la localización y del tamaño del NT, lo cual se logra por lo general cuando es > a 1 cm.
.- Tiroides es visible difusamente, cuando tiene un volumen de 30 a 40 cc. (2)
.- Nódulo palpable en tiroides, que cuando es mayor de 4 cm, duro y fijo se considera de riesgo para malignidad.
.- Adenomegalias no reactivas (riesgo clínico para malignidad).
2).- Laboratorios.
.- No hay laboratorios necesarios para el diagnóstico de los nódulos tiroideos, pero es de utilidad los siguientes:
2.1).- Hormonas tiroideas:
.- TSH: con el fin de realizar diagnósticos de hipertiroidismo clínico y subclínico, lo cual sería indicación de la GMG tiroidea en busca de adenomas tiroideos inhibidores tóxicos o no respectivamente (patrón de nódulos calientes). Este dosaje tiene una Moderada Calidad de Evidencia (MCE) y una Recomendación Fuerte (RF)
.- T4 y T3: con el mismo objetivo de la TSH.
2.2).- Calcitonina sérica.
La medición de calcitonina sérica es controversial, ya que la ATA la tiene como recomendación 4 (ni a favor ni en contra), pero el Consenso Argentino de Endocrinología (Pitoia F et al. Revista Argentina de Endocrinología Metab 2014; 51:85-118) si la recomienda (Recomendación 1), con el fin de realizar diagnóstico diferencial entre adenoma tiroideo con la hiperplasia de células C o con el cáncer medular de tiroides (CMT). El CMT tiene una incidencia en los nódulos tiroideos del 0,4 al 5,6%. El valor de la CT sérica se relaciona con el tamaño o extensión tumoral.
Indicación del dosaje de calcitonina:
- Pacientes con PAAF con Bethesda III, IV o V con intención de tratamiento quirúrgico, porque de poseer CMT cambia el abordaje quirúrgico.
- Pacientes con sospecha citológica de CMT.
- Pacientes con bocio nodular y antecedentes familiares de CMT.
- Paciente con antecedente de NEM2.
- No está indicado en todos los nódulos tiroideos.
El dosaje de calcitonina es una prueba con alta S y bajo VPP, pero cuando el nivel de calcitonina no estimulado es >100 pg/ml tiene un VPP del 100% para CMT, sin embargo debido a que desde un 56 a un 88% de las personas normales tienen valores inferiores al de la sensibilidad para la prueba de laboratorio, para realizar el dosaje con el fin de aumentar la S y E de la prueba debe realizarse con test estimulatorios con pentagastrina o de calcio:
.- Test estimulatorio con pentagastrina: (No sé si esté disponible en Colombia).
- Dosis 0,5 µg/Kg.
- Máximo estímulo en hombre: 37.8 pg/ml.
- Máximo estímulo en mujer: 26.2 pg/ml.
- Valores > a 1.000 pg/ml, tienen una VPP del 100% para CMT.
.- Test estimulatorio con calcio:
- Dosis: infusión de Carbonato de Calcio 2,5 mg/Kg en 30 segundos.
- Máximo estímulo en mujer Hipercalcemia (porque su principal función: 131 pg/ml
- Máximo estímulo en hombre: 90.2 pg/ml
NOTA: Importante tener en cuenta los falsos positivos (lactancia, embarazo y tabaquismo), así como los estados patológicos que aumentan su nivel sin ser un CMT, entre los que tenemos (Ver tema de células parafoliculares):
- Hipercalcemia (porque su principal función es disminuir los niveles séricos de calcio).
- Pseudohipoparatiroidismo.
- Enfermedad tiroidea autoinmune.
- Anticuerpos heterófilos.
- Tumores neuroendocrinos, productores de Colecistocinina, gastrina, glucagón o secretina.
- Tumores de pulmón.
- Mastocitosis.
- IRC.
- Sepsis.
- Iatrogenia: Estrógenos, uso crónico de IBP, magnesio a dosis terapéuticas, liraglutida (análogo del GLP-1) y agonista B-adrenérgicos (salbutamol, dopamina).
2.3).- Anticuerpos antitiroglobulina (AbTG)
El 25% de los CDT presentan AbTG positivos antes de las cirugía, y la única indicación prequirúrgica es con el fin de evaluar su presencia, ya que cuando están presentes se presenta interferencia con la medición de la TG posquirúrgica. Por eso es relevante su dosaje solamente en los pacientes con nódulo tiroideo que vayan a ser sometidos a tratamiento quirúrgico por sospecha de malignidad o cuando ya existe el diagnóstico de CDT.
2.4).- Test moleculares:
Con el fin de realizar el diagnóstico prequirúrgico no histopatológico de los nódulos tiroideos Bethesda III o IV o sea para definir la naturaleza benigna o no de los nódulos con citología indeterminada, lo cual puede cambiar la recomendación terapéutica. Se realiza de la muestra de PAAF.
Existen 3 test moleculares: Afirma ®, ThyroSeq ® o ThyraMIR ® / ThyGenX ®
.- Test molecular AFIRMA ® (Veracyte): Evalúa 167 genes, cuyo resultado puede ser:
- Benigno con una S: 92% y E: 48- 52% con un VPN: 93%,
- Sospechoso o
- Sin resultados.
Pudiendo además identificar CMT, metástasis a tiroides y neoplasia paratiroidea. Por lo cual el 52% de los nódulos Bethesda III y IV no se someterían a cirugía porque el AFIRMA los identificaría como benignos.
.- Test molecular THYROSEQ 2,0 ® (NSG) desarrollado en la U. de Pittsburg. Según este test los Bethesda III y IV tienen una prevalencia de malignidad del 27%, teniendo la prueba una S: 90%, E: 93%, VPP: 83% y VPN: 96% (pero el estudio de investigación tubo un diseños subóptimo, porque no estaba enmascarado).
Mediante este test podemos identificar marcadores moleculares de malignidad para 112 genes relacionados entre los que se encuentran mutaciones para los genes BRAF, RAS, RET/PTC, PAX8/PPAR gamma, TERT, TP53.
.- Test molecular ThyraMIR ® y ThyGenX ®, el cual detecta 8 oncogénes.
3).- Imágenes
3.1).- US de tiroides:
.- Indicaciones. La ATA solo la indica en:
- Bocio.
- Nódulos palpables.
- Nódulos detectados incidentalmente con TC, RM o PET.
- Pacientes con palpación tiroidea normal pero con factores de riesgo clínicos para malignidad.
Anotar que en el 5,6% de los PET se encuentran nódulos tiroideos incidentales; de éstos el 43% (2.42%) tienen captación focal, el 49% (2,75%) tienen captación difusa y el 8% (0,43%) poseen captación mixta. De los que poseen captación focal el 50% son cáncer de tiroides y de los que tienen captación difusa lo son el 20% de los casos.
La US de tiroides debe reportar los siguientes datos:
.- Tamaño glandular (AP, longitudinal y transversal).
.- Sonoanatomía del parénquima glandular adyacente al nódulo:
- Ecogenicidad: Hiper – iso – hipo ecogénico.
- Aspecto: Homogéneo o Heterogéneo.
.- Número de nódulos:
- Único o nódulo solitario.
- Múltiples.
..- Localización del nódulo tiroideo:
- Anterior
- Posterior (en ésta localización la PAAF es muy difícil guida por palpación).
.- Tamaño del nódulo (AP, longitudinal y transversal), (más alto que ancho es S y E para malignidad).
.- Halo periférico:
- Presente completo o incompleto.
- Ausente.
.- Márgenes:
- Regulares.
- Irregulares, que pueden ser espiculados, microlobulados o infiltrativos (E y S para riesgo de malignidad).
.- Ecogenicidad del nódulo (respecto del parénquima tiroideo):
- Hipoecoico (E y S para riesgo de malignidad).
- Hiperecoico.
- Isoecoico.
.- Naturaleza del nódulo:
- Quístico verdadero (benigno),
- Quístico coloide (benigno),
- Mixto o complejo, cuando el componente quístico es mayor del 50% del volumen del nódulo es difícil realizar la PAAF guiada por palpación. (E y S para riesgo de malignidad).
- Sólido (E y S para riesgo de malignidad).
- Espongiforme (E y S para riesgo de malignidad).
.- Calcificaciones a nivel del nódulo:
- Microcalcificaciones (E y S para riesgo de malignidad).
- Calcificaciones periféricas interrumpidas con partes blandas (E y S para riesgo de malignidad).
- Calcificaciones en el borde o en “cáscara de huevo”, que incluso puede ser un componente de benignidad o en el peor de los casos de baja sospecha.
.- Evaluación de los ganglios del compartimento central y lateral del cuello y en caso de encontrar adenomegalias, se debe describir (ver adelante en US de adenomegalias).
- Forma.
- Descripción del hilio del ganglio linfático.
- Vascularización.
- Patrón parénquima (heterogéneo, homogéneo, etc).
- Ecogenicidad (hiper – iso – hiperecogénico).
- Microcalcificaciones.
De acuerdo a la descripción de las características ecográficas anotadas, los nódulos tiroides se clasifican en 5 categorías respecto del riesgo de cáncer de tiroides:
VER GRAFICO 403 CUADERNO AZUL.

Aclaraciones importantes sobre patrones ecográficos de los nódulos tiroideos:
.- En la guía ATA 2015 se recomienda (Recomendación 8) que los nódulos tiroideos menores de 1 cm de diámetro que no posean ecográficamente evidencia de extensión extratiroidea, ganglios linfáticos metastásicos cervicales o metástasis a distancia, así posean las demás características de un patrón de alto riesgo ecográfico de malignidad, no se recomienda tomar BAAF, porque en el peor de los casos podría tratarse de un microcarcinoma papilar de tiroides (MCPT), el cual como se verá en el tratamiento puede ser manejado con sola vigilancia activa, entonces no tiene importancia realizar el diagnóstico si el manejo es el mismo. Se exceptúa de lo anterior cuando además del nódulo se evidencian ganglios linfáticos cervicales sospechosos clínica o ecográficamente de ser metástasis, caso en el cual independientemente del tamaño del nódulo se debe realizar la BAAF tanto al nódulo como a al (los) ganglio(s) sospechoso(s).
Para evitar confusiones debemos decir que en el consenso argentino de tiroides solo recomienda no realizar BAAF en nódulos < 1 cm solo en caso que no presente características de agresividad.
.- Los nódulos que presentan patrón de riesgo bajo y muy bajo de sospecha de malignidad, el riesgo es principalmente para cáncer folicular de tiroides (CFT) y el cáncer papilar de tiroides variedad folicular (CPTVF) y por eso, debido a que el CFT solo realiza metástasis cuando tiene un tamaño mayor de 2 cm, entonces en los nódulos de muy baja sospecha ecográfica el punto de corte para indicar la PAAF es esta medida.
.- El patrón ecográfico hipoecoico de un nódulo, quiere decir que se ve oscuro en la US porque está constituido por estructuras blandas que hace que se dé menos ecos el ultrasonido (podría decirse en términos coloquiales y simplistas que el ultrasonido “pasa derecho” ´porque la estructura estudiada es blanda y no “rebota o hace eco”). También se puede decir que hipoecoico se ve menos del estándar (se ve oscuro o negro), y si estuviéramos hablando de Rx hipoecoico es radiolúcido (negro). Cuando la imagen de un nódulo es hipoecoico tiene una sensibilidad del 50% para ser cáncer de tiroides (al parecer la sensibilidad para esta característica se da cuando el nódulo tiene riesgo para cáncer papilar de tiroides (CPT) exclusivamente – falta corroborar esta afirmación en la guía ATA, porque está confuso-)
.- En contraposición en las imágenes de los nódulos hiperecoicos, se observa de color blanco, porque el ultrasonido hace más ecos o “rebota” porque está constituido por material que causa eco, tal como hueso, calcificaciones, cartílago, agua o la sangre. También se puede decir que hiperecoico se ve más que el estándar (se ve blanco); si estuviéramos hablando de Rx, hiperecoico es radiopaco (banco).
NOTA: Según el Dr EW las características ecográficas graduación sensible y específica para malignidad de los nódulos tiroideos son:
- Forma más alta que ancha +++
- Bordes irregulares +++
- Microcalcificaciones ++
- Vascularización central++
- Nódulo sólido +
- Hipoecoico +
NOTA: Otro documento describe la S y E de cada una de las características ecográficas para malignidad de los nódulos tiroideos.
3.2).- Eco Doppler de tiroides:
.- Patrón vascular.
- Nódulo avascular con circulación periférica (halo periférico).
- Distribución o circulación central.
.- Índice de resistencia.
.- Velocidad sistólica máxima.
El patrón vascular intranodular, tiene utilidad como predictor de malignidad dependiendo del tipo de cáncer, así:
.- Cáncer Papilar de Tiroides (CPT): tiene bajo valor predictivo positivo.
.- Cáncer Folicular de Tiroides (CFT): tiene correlación positiva con malignidad.
Sin embargo estos parámetros no son útiles para distinguir malignidad (el patrón vascular está en franca discordancia con lo manifestado por el Dr EW).
3.3).- US de adenomegalias:
Cuando se hace la US de tiroides siempre se debe estudiar los ganglios de los compartimentos centrales y laterales del cuello y en caso de encontrar adenomegalias se deben describir, con el fin de diferenciar entre una adenopatía y una adenomegalia reactiva. VER GRAFICO 404 CUADERNO AZUL.
La descripción que se debe realizar de una adenomegalia es:
.- Forma:
- Ovalada u ovoide (adenopatía reactiva).
- Redonda o irregular (predictiva malignidad).
.- Bordes:
- Bien definidos y lisos (adenopatía reactiva).
- Mal definido con edema de tejido periférico (predictiva malignidad).
.- Parénquima:
- Homogéneo, hipoecoico en la periferia, sin alteraciones focales.
- Parénquima irregular con necrosis intraganglionar (predictiva malignidad).
- Parénquima con cambios quísticos (predictiva de malignidad con E del 100%)
- Calcificaciones (predictiva malignidad).
.- Hilio central:
- Hiperecoico (adenopatía reactiva).
- No se visualiza o pérdida (isoecoico) (predictiva malignidad).
.- Tamaño:
- > 1 cm de diámetro AP.
- Alteración en la vasculatura.
Recordar que un dx diferencial de las calcificaciones y necrosis intraganglionares es la TBC ganglionar.

Si el ganglio estudiado es sospechoso de acuerdo a estos signos ecográficos se debe solicitar PAAF del ganglio linfático y en lo posible también medición de TG en el aspirado.
Los ganglios más afectados son los del nivel VI, III y IV.
3.5).- GMG de tiroides.
Indicaciones en nódulo tiroideo (NT):
.- En NT con PAAF con BETHESDA I: INDETERMINADO.
.- En TSH baja o subnormal (o sea un hipertiroidismo subclínico y no necesariamente suprimida) tiene Recomendación Fuerte (RF) y Moderada Calidad de Evidencia (MCE), buscando realizar el diagnóstico de adenoma inhibidor tóxico.
Tiene por función evaluar la dinámica del metabolismo intratiroidéo del yodo y la estructura glandular funcional (morfología). Cuando se realiza con yodo se puede evaluar tanto la funcionalidad como la morfología glandular, mientras que cuando se realiza con Tc99m solo se evalúa la morfología glandular (porque el Tc999m no se incorpora al metabolismo de las hormonas porque lógicamente no es organificado).
Clasificación de los nódulos / adenomas tiroideos de acuerdo a la funcionalidad.
Esta clasificación se realiza de acuerdo a la funcionalidad del nódulo y medido mediante la gammagrafía.
I).- Nódulo / adenoma tiroideo no funcionante o frío:
Es un nódulo sin actividad en la gammagrafía o sea que no capta; la gammagrafía del resto de la glándula es normal, los niveles de TSH y T4 son normales.
II).- Nódulo / adenoma tiroideo funcionante templado:
Es un nódulo donde la captación en gammagrafía es normal como en el resto de la glándula; la gammagrafía del resto de la glándula es normal, los niveles de TSH y T4 son normales.
III).- Nódulo / adenoma tiroideo funcionante caliente parcialmente inhibidor:
Es un nódulo que aparece más intenso en gammagrafía que el resto de la glándula; la gammagrafía del resto de la glándula se aprecia pero de menor intensidad que el nódulo, los niveles de TSH pueden estar inhibidos o no y la T4 es normal.
IV).- Nódulo / adenoma tiroideo funcionante caliente inhibidor - No tóxico:
En la gammagrafía solo el nódulo registra actividad, el resto de la glándula no capta el trazador en la gammagrafía, pero en la ecografía encontramos una glándula de tamaño normal, morfología normal; los niveles de TSH están inhibidos y la T4 es normal.
V).- Nódulo / adenoma tiroideo funcionante caliente inhibidor - Tóxico:
Es igual al anterior pero con niveles altos de T4 y T3 (principalmente T3) o sea que causa tirotoxicosis por hiperfunción de los tirocitos nodulares, por tanto es un tipo de hipertiroidismo.
VI).- Nódulo discordante:
Entre el 3 y 8% de los nódulos que aparece caliente cuando se usa 99mTc-Pertecnetato de sodio y frio cuando se una con 123I o 131I, lo cual se debe a que el primero es captado pero no organificado ni incorporado a la síntesis de HT, mientras el segundo sí; este es un comportamiento típico del cáncer de tiroides. Por eso todo nódulo caliente con 99mTc-Pertecnetato de sodio, se le debe realizar la GMG con 123I o 131I.
Los patrones de la GMG de tiroides en cada tipo funcional de nódulos tiroideos es:
4).- Otras ayudas diagnósticas:
4.1).- Biopsia Punción Aspirativa con Aguja Fina (PAAF) del nódulo tiroideo:
S: 90 -95% y E: 85 a 97%.
La E varía dependiendo operador dependiente (quien realice la PAAF y la lectura). La PAAF da menos falsos negativos cuando se realiza guida por ecografía y no por palpación y no se debería realizar guida por palpación si el nódulo tiene contenido quístico mayor al 25% o es de localización posterior.
Indicación: Según la ATA la PAAF está indicada en todo nódulo tiroideo con:
.- Patrón ecográfico de alto riesgo ≥ 1 cm,
.- Patrón ecográfico de riesgo intermedio ≥ 1 cm.
.- Patrón ecográfico de riesgo bajo ≥ 1.5 cm.
.- Patrón ecográfico de muy bajo riesgo ≥ 2 cm.
.- Nódulos tiroideos subcentrimetricos, pero que se acompañan de ganglios linfáticos con signos USgráficos sugestivos de malignidad.
No está indicada en nódulo tiroideo que se clasifica como "quiste simple".
Se realiza con una aguja calibre 21-23, sin anestesia general.
El reporte de la biopsia por PAAF se realiza mediante el sistema de BETHESDA, así:
(14)
4.2).- PAAF en adenopatías:
Cuando se encuentra una adenopatía con signos USgráficos sospechosos se debe realizar PAAF sin importar el tamaño del ganglio, con el fin de realizar:
.- Estudio citológico del aspirado.
.- Estudio de TG en líquido aspirado con la PAAF.
TRATAMIENTO DEL LOS NODULOS TIROIDEOS
Indicaciones del tratamiento quirúrgico de los nódulos tiroideos:
- Nódulos tiroideos sospechosos para malignidad según sistema Bethesda.
- Nódulos tiroideos con uno o más factores de riesgo clínico de alta sospecha.(2)
- Nódulos tiroideos con dos o más factores de riesgo clínico de moderada sospecha. (2)
- Nódulos tiroideos que no cumplen los anteriores criterios pero son mayores de 4 cc, cuya indicación es costo beneficio.
VER GRAFICO 408 CUADERNO AZUL.
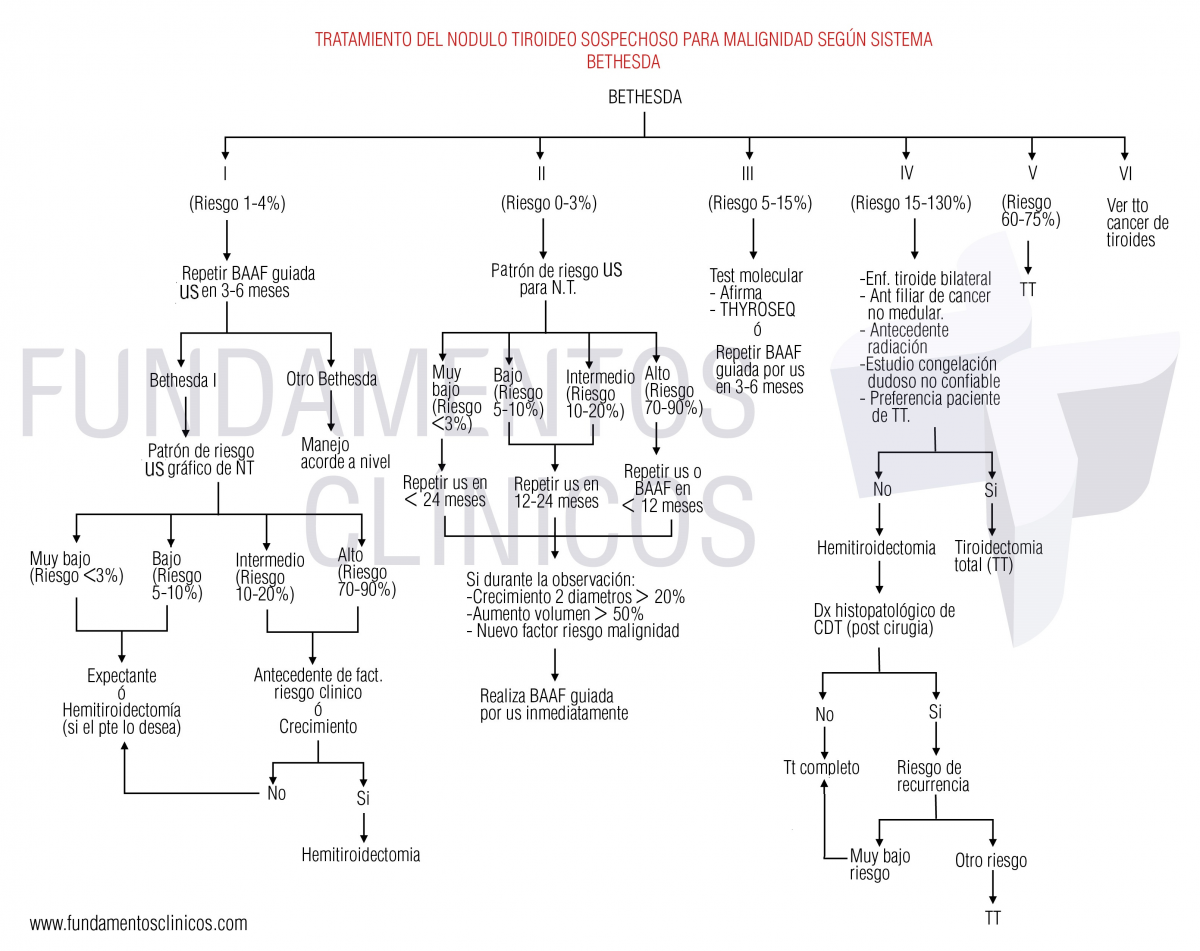
A).- Tratamiento de los nódulos tiroideos sospechosos para malignidad según el sistema BETHESDA:
Bethesda I:
Hasta el 2 al 16% de los ACAF son Bethesda I, el cual según la según revisión del Sistema Bethesda 2017 (14) tiene un riesgo estimado de malignidad del 5 al 10%, en el que se puede seguir una de las siguientes conductas (1) Recomendación 10 (Recomendación débil – baja calidad evidencia):
.- Repetir la biopsia PAAF obligatoriamente guida por US en 3 a 6 meses.
.- Si el resultado es diferente se sigue el manejo según la nueva categoría.
.- Si el resultado es nuevamente I, entonces el manejo depende de las características ecográficas:
- Patrón ecográfico de muy baja (riesgo <3%) o de baja sospecha (riesgo de 5 a 10%), la conducta es expectante. Sin embargo si el paciente lo desea el tratamiento quirúrgico de hemitiroidectomía también es adecuado.
- Patrón ecográfico de sospecha intermedia (riesgo de 10 – 20%) o alta sospecha (riesgo de 70 a 90%) la conducta depende de los antecedentes de riesgos clínico para malignidad que posea el paciente o si en el seguimiento se produce un crecimiento del nódulo la conducta es quirúrgica con hemitiroidectomía. Si no se presenta estas situaciones y el paciente está de acuerdo la conducta es expectante.
Bethesda II:
Hasta el 2 al 16% de los ACAF son Bethesda I, el cual según la según revisión del Sistema Bethesda 2017 (14) tiene un riesgo estimado de malignidad del 5 al 10%, en el que se puede seguir una de las siguientes conductas (1) Recomendación 10, de acuerdo al patrón ecográfico: (Recomendación débil – baja calidad evidencia):
.- Patrón ecográfico de alta sospecha (riesgo 70 a 90%): repetir la US o la PAAF antes 12 meses.
.- Patrón ecográfico de intermedia (riesgo de 10 a 20%) y baja sospecha (riesgo 5 a 10%): repetir la US en 12 a 24 meses.
.- Patrón ecográfico de muy baja sospecha (riesgo < 3%): repetir la US después de los 24 meses.
.- Si durante el seguimiento se da un crecimiento del diámetro mayor al 20% en 2 diámetros o volumétrico mayor al 50% o aparece una nueva característica sospechosa, se debe realizar nueva PAAF inmediatamente.
Bethesda III:
Hasta del 1 a 27% de los ACAF son Bethesda III, el cual según la según revisión del Sistema Bethesda 2017 (14) tiene un riesgo estimado de malignidad del 9 al 18%, en el que se puede seguir una de las siguientes conductas (1) Recomendación 15 (Recomendación débil – moderada calidad evidencia):
- Solicitar una segunda opinión de lectura de las mismas láminas (variabilidad interobservador), donde la mayoría serán releídas como tipo I o II.
- Repetir el ACAF ecoguiado en 3 a 6 meses, siendo que del 10 al 30% serán nuevamente tipo III y en el resto la gran mayoría serán tipo I o II. (15)
- Test molecular, Afirma ®, Thyroseq ® (15)
- Realizar imágenes moleculares (99mTc-Sestamibi o 18FDG) en las cuales si presenta avidez por estos trazadores el riesgo de malignidad es del 35% (16) (17). Mientras que si no tiene o es muy baja la captación el riesgo de malignidad es muy bajo (4). La EANM recomienda que antes de tomar las imágenes moleculares se realice una gammagrafía de tiroides con el fin de solo tomar estas imágenes a los nódulos hipocaptantes, ya que tienen un riesgo de malignidad del 10 a 20%, mientras que los hipercaptantes tienen un VPN para malignidad del 96 al 99%. (18) (19) (20)
Dependiendo del resultado de los anteriores conductas se realiza: (1) (Recomendación fuerte y baja calidad de evidencia).
- Seguimiento activo, o
- Cirugía diagnóstica.
Bethesda IV:
Hasta del 1 al 25% de los ACAF son Bethesda IV, el cual según la según revisión del Sistema Bethesda 2017 (14) tiene un riesgo estimado de malignidad del 10 a 40%, en el que se puede seguir una de las siguientes conductas:
- Test molecular con el fin de conocer el diagnóstico, (1) Recomendación 16 (Recomendación débil – moderada calidad evidencia):
- Realizar imágenes moleculares (99mTc-Sestamibi o 18FDG). (18) (19) (20)
Dependiendo del resultado de este o si no se realizaron la conducta es: (Recomendación fuete, con baja calidad de evidencia)
1).- En caso que el resultado de los anteriores sea de un nódulo benigno (Bethesda II) se realiza el seguimiento correspondiente (recomendación 11 y 23 (1)).
2).- Si el resultado es sospechoso o sin resultados se realiza tiroidectomía total o hemitiroidectomía dependiendo si son positivas o no los siguientes factores de riesgo:
- Enfermedad tiroidea bilateral (tiroidectomía total).
- Antecedente de radiación (tiroidectomía total).
- Antecedente familiar de cáncer de tiroides (tiroidectomía total).
- Si el estudio por congelación intraoperatorio es dudoso o no confiable (tiroidectomía total).
- Preferencia del paciente de tiroidectomía total.
3).- Si el resultado es maligno, el manejo es como un Bethesda VI.
Si luego de la hemitiroidectomía se confirma el dx de CDT, la conducta depende del riesgo de recurrencia, así:
- Muy bajo riesgo (microcarcinoma + histología no agresiva): es suficiente la lobectomía.
- Resto de riesgos: se debe realizar la tiroidectomía total.
Bethesda V:
Hasta del 1 al 6% de los ACAF son Bethesda IV, el cual según la según revisión del Sistema Bethesda 2017 (14) tiene un riesgo estimado de malignidad del 45 a 60%, en el que se puede seguir una de las siguientes conductas:
.- Test molecular: Si las características clínicas y ecográficas no son sospechosas de malignidad, se puede realizar los test moleculares, ya que si el resultado es benigno puede cambiar la conducta. (Recomendación débil y moderada calidad de evidencia).
.- Tiroidectomía total: si no se realizó el test molecular o si se realizó con resultado sospechoso o sin resultado. (Recomendación fuerte y bajo calidad de evidencia).
Bethesda VI:
.- En forma general se puede decir que es Tiroidectomía total + vaciamiento ganglionar, pero para más detalle ver capítulo de cáncer de tiroides y su tratamiento.
B).- Tratamiento de nódulos tiroideos con síntomas de hipertiroidismo subclínico clínico por adenomas calientes inhibidores no tóxicos y tóxicos:
Los NT calientes inhibidores no tóxicos se diagnostican con una TSH subnormal y hormonas tiroideas normales (hipertiroidismo subclínico); y los tóxicos se diagnostican con TSH suprimida con hormonas tiroideas elevadas (hipertiroidismo – tirotoxicosis). El patrón gammagráfico para estos nódulos es igual, consistente en un nódulo hipercaptante y una glándula tiroides no captante. Estos NT tienen 3 opciones de tratamiento, escogiéndose de acuerdo a características clínicas y demográficas del paciente:
.- Tratamiento quirúrgico con hemitiroidectomía o lobectomía o istmectomia, cuyas indicaciones son:
- Necesidad de corrección rápida del estado tirotóxico.
- Síntomas o signos compresivos (disfonía, disfagia o disnea).
- Glándula tiroides muy grandes >80 gr (VN de 25 a 30 gr).
- Extensión subesternal o retroesternal.
- Sospecha de coexistencia de cáncer de tiroides.
- Hiperparatiroidismo coexistente.
La prevalencia de hipotiroidismo posquirúrgico va del 2-3%.
.- Tratamiento con Yodo radiactivo 131, cuyas indicaciones son:
- Edad avanzada del paciente.
- Comorbilidad significativa.
- Masa del nodulo pequeña.
- Cirugía de cuello previa.
- No disponibilidad de cirujano experto (riesgo de hipoparatiroidismo y lesión del N. laríngeo recurrente).
Este tratamiento tiene una tasa de respuesta a los 3 meses del 75% y a los 12 meses es del 89%, presentando hipertiroidismo persistente en 6 a18% de los casos, y de hipertiroidismo recurrente del 3 a 5,5%.
La prevalencia de hipotiroidismo pos IRA va del 2 hasta el 18% pero esto depende de:
.- Presencia de autoinmunidad tiroidea.
.- TSH no suprimida al momento del tratamiento, entre menos suprimida (valor más alto) más posibilidad de hipotiroidismo.
.- Tratamiento previo con antitiroideos.
.- Tratamiento médico con FAT de largo plazo, (Metilmercaptoimidazol) cuyas indicaciones son:
- Edad avanzada.
- Comorbilidades.
- Disminución de la esperanza de vida.
- Pobre candidato a terapia ablativa con IRA.
C).- Terapia supresiva con levotiroxina en nódulos tiroideos benignos confirmados por PAAF, para disminuir su tamaño y evitar crecimiento: NO RECOMENDADO POR LA ATA (Recomendación fuerte con Alta Calidad de Evidencia).
La terapia supresiva con levotiroxina consiste en llevar el paciente a valores reducidos de TSH (0,1 a 0,2 mU/L) con valores de HT normales o sea en un estado de hipertiroidismo subclínico pero inducido por levotiroxina, lo cual causa una reducción del volumen nodular basal > al 50% en un 17% de los casos e inhibe el crecimiento en el 10% de los casos. Sin embargo un metaanálisis (1) de 9 estudios bien diseñados metodológicamente con un seguimiento a 5 años, demostraron que luego de suspender la terapia se presentaba nuevamente crecimiento y en cambio en terapias a largo plazo se presentan los siguientes efectos colaterales:
.- Cardiovasculares: arritmias supraventriculares principalmente FA, masas VI, disminución tolerancia al ejercicio.
.- Disminución masa mineral ósea (MMO), con incremento de 3 a 4 veces tasas de fracturas vertebrales y de cadera.
.- Al suspender el tratamiento crece rápidamente el nódulo nuevamente.
- Efficacy of Thyroid hormone suppression for benign Thyroid Nodule: Meta-analysis or randomized Trial. Steewar et al. Cincinnati, Ohio; Otolaryngology – Head and Neck surgery 2005; 133: 391-396.
Por lo anterior solo se recomienda a los pacientes con NT benigno una ingesta adecuada de yodo (incluso si se encuentra o sospecha déficit de yodo se recomienda un suplemento diario de yodo de 150 microg.), sin terapia supresiva por los riesgos que conlleva. Recomendación Fuerte con Moderada Calidad de Evidencia.
BIBLIOGRAFIA DE NODULOS TIROIDEOS
