TRATAMIENTO DEL CÁNCER DIFERENCIADO DE TIROIDES (CDT):
Para pacientes con BACAF con Bethesda VI para CDT, la guía ATA 2015 recomienda el siguiente tratamiento:
1).- Evaluación prequirúrgica.
Se deben realizar todas las medidas diagnósticas descritas en el diagnóstico de los nódulos tiroideos, pero especialmente cuando se tiene el diagnóstico del CDT se debe realizar:
1.1).- Laboratorios clínicos:
- Calcitonina sérica (ver dx de NT).
- Anticuerpos antitiroglobulina (AbTG) (Ver dx de NT).
1.2).- Imágenes prequirúrgicas:
- US de cuello: de rutina en todos los pacientes con dx de CDT (ver dx de NT).
- TC con contraste yodado (en lo posible hidrosoluble no iónico) en caso de:
- Síntomas de compromiso local como disnea, disfagia, disfonía, tos, estridor, hemoptisis, etc.
- Tumor > 4 cm.
- Parálisis de cuerdas vocales, y
- Sospecha de M1.
- RM con contraste: igual indicaciones que la TC.
- PET- CT con 18F-FDG: en sospecha de M1.
1.3).- Estudio de vías aerodigestivas: en sospecha de invasión de estas vías, mediante:
- Esofagoscopia.
- Broncoscopia.
1.4).- Evaluación de cuerdas vocales antes de la cirugía (laringoscopia):
- Debe realizarse en todo paciente que se vaya a someter a cirugía por CDT.
- El 2% de los pacientes con CDT tienen parálisis de cuerdas vocales (el 50 a 67% casos son asintomáticos).
2).- Vigilancia activa en microcarcinomas papilares de tiroides – MCPT- (Recordación 12 de la guía ATA p.18):
Se define microcarcinoma papilar de tiroides (MCPT) a un tumor papilar de tiroides <1 cm intratiroidéo e intraparenquimatoso.
2.1).- Candidato con microcarcinoma papilar de tiroides (MCPT) ideal para vigilancia activa:
- No haya evidencia clínica de metástasis regional (N0) ni a distancia (M0).
- MCPT intraparenquimatoso que no esté en contacto con la cápsula ni sea posterior.
- Si se realizó test molecular o estudio genético, no se reporte variedades agresivas tales como CPT variedad células altas, células columnares o esclerosante difuso.
- Paciente mayor de 60 años, con buena expectativa de vida (porque los TP que se manifiestan luego de esta edad son los que presentan una menor posibilidad de progresión).
- Paciente que requiera tratamiento previo a la cirugía tiroidea.
- Paciente con alto riesgo quirúrgico.
- Paciente con corta expectativa de vida (enfermedad cardiovascular avanzada, otra malignidad, edad avanzada, etcétera).
2.2).- Candidato con microcarcinoma papilar de tiroides (MCPT) posible pero no ideal para vigilancia activa:
- Nódulos subcapsulares anteriores o laterales (pero no los posteriores).
- Nódulos múltiples.
- Asociados a tiroiditis linfocitaria crónica (T. de Hashimoto).
- Mayores de 18 años.
- Búsqueda de fertilidad y
- Historia familiar de CPT.
2.3).- No son candidatos o son inapropiados para seguimiento activo los microcarcinoma papilar de tiroides (MCPT) siguientes:
- Evidencia de metástasis regionales o a distancia.
- Evidencia de invasión a estructuras vecinas.
- Nódulos subcapsulares posteriores, porque su crecimiento puede comprometer la tráquea; aunque, manifiesta el Dr. Pitoia, que si en la TC el ángulo del TP con la tráquea es agudo la posibilidad de infiltración es menor y por tanto se podría hacer seguimiento (arriesgado?).
- Variedades agresivas CPT (CPT células altas, células columnares o esclerosante difuso).
- Menores de 18 años (son carcinomas más agresivos).
- Poca adherencia a seguimiento.
3).- Manejo quirúrgico:
3.1).- Lobectomía:
.- MCPT (tumor < 1 cm) que no se realice vigilancia activa pero que cumpla:
- TP único (no afectación contralateral).
- Intratiroidéo o sea sin compromiso capsular.
- CPT variedad clásica.
- Sin antecedente personal de irradiación en cuello.
- Sin antecedente familiar de CPT.
.- Tumor ≤ 4 cm que cumpla con lo siguiente:
- No evidencia de metástasis ganglionar o a distancia.
- Unifocal intratiroidéo.
- No antecedente personal de radiación cervical.
- No antecedente familiar de CPT tipo familiar.
NOTA: La guía ATA 2015, también avala la TT para estos pacientes.
NOTA: El consenso Argentino de Tiroides solo recomienda lobectomía para los MCPT, el resto recomienda TT.
3.2).- Tiroidectomía total (TT) sin vaciamiento ganglionar:
.- MCPT (tumor < 1 cm) en el que no se pueda realizar lobectomía o sea:
- Nódulos tiroideos contralaterales, así sean benignos.
- TP múltiples.
- Antecedente personal de irradiación en cuello.
- Antecedente familiar de CPT.
- Edad mayor a 45 años.
- Intratiroidéo o sea sin compromiso capsular.
- Sin metástasis ganglionar o a distancia clínica evidente al momento de la cirugía.
- Voluntad del paciente.
.- Tumor > 1 cm y < de 4 cm que cumpla:
- Sin metástasis ganglionar o a distancia clínica evidente.
- Intratiroidéo sin compromiso capsular.
3.3).- TT + Linfadenectomía profiláctica del compartimento central (nivel VI).
.- Tumor > 4 cm intratiroidéo sin metástasis ganglionares clínicas evidentes al momento de cirugía.
.- Tumor de cualquier tamaño con invasión capsular o estructuras vecinas sin metástasis ganglionares clínicas evidentes al momento de cirugía.
.- Tumor de cualquier tamaño de variedades agresivas sin metástasis ganglionares clínicas evidentes al momento de cirugía.
El vaciamiento ganglionar central profiláctico se asocia con una mayor morbilidad debido a posible lesión de glándulas paratiroides y nervio recurrente laríngeo.
El vaciamiento profiláctico del compartimento lateral cervical (nivel III y IV) no tiene indicación en ningún caso (Recomendación 13 Consenso intersocietario Argentino del Tto del CDT-2014).
En caso que se haya realizado una TT en un nódulo tiroideo Bethesda IV (o sea un NT con citología por PAAF de neoplasia folicular o sospechosa de neoplasia folicular); o por un NT Bethesda V (o sea un NT con citología por PAAF sospechosa de malignidad), (ver tratamiento de nódulos tiroideos) o por cualquier otra causa de patología benigna y luego por histopatología definitiva postquirúrgica se comprueba CDT, no está indicada el vaciamiento ganglionar diferido de la celda tiroidea (Recomendación 14 Consenso intersocietario Argentino del Tto del CDT-2014).
3.4).- TT+ Linfadenectomía central terapéutica.
.- En cualquier afectación ganglionar clínica o radiológica y confirmada citológicamente, independiente de las características del TP.
No está indicada la remoción aislada de adenopatías comprometidas (Berry picking), porque se asocia a persistencia y recurrencia.
Si solo hay evidencia de afectación ganglionar en los niveles del compartimento central, es suficiente su solo vaciamiento, pero si la afectación es del lateral se debe vaciar este más el central, así el central esté libre de metástasis radiológica y clínica.
Por lo general solo es necesario el vaciamiento de niveles centrales VI (uni o bilateral) y VII o de éstos y los niveles laterales II, III, IV y V.
La metástasis a ganglios cervicales superiores (niveles IIb y Va) es rara y por tanto si la afectación de los ganglios de los niveles IIa y Vb es baja se puede obviar el vaciamiento de estos niveles localizados por encima del nervio espinal accesorio (evitándose el riesgo de su lesión).
El vaciamiento ganglionar clásico asociado a remoción del músculo ECM, vena yugular interna y nervio espinal, solo está indicado en invasión extraganglionar masiva.
3.5).- TT+ Linfadenectomía central profiláctica o terapéutica + resección extratiroidea.
.- Tumor con cualquier invasión extratiroidea, dependiendo el órgano afectado así:
.- Tráquea:
- Invasión superficial limitada: procedimiento de limpieza (“shaving”).
- Invasión profunda limitada: resección y reconstrucción con colgajos locales.
- Invasión circunferencial o extensa: resección segmentaria (hasta 4 o 5 anillos) y anastomosis término terminal
.- Faringe o esófago:
- Por lo general se limita a la capa muscular: resección de la misma, respetando la mucosa
.- Nervio recurrente laríngeo:
- Compromiso masivo unilateral (con parálisis cordal) debe ser resecado.
- Con cuerda vocal funcional y contralateral paralizada, es aceptable dejar enfermedad microscópica sobre el nervio.
- Con compromiso anatómico y funcional bilateral: traqueostomía.
- Cuando es resecado la reinervación para recuperar el tono muscular exclusivamente, se realiza con el usando el ansa hipoglosi.
.- Compromiso vascular:
- Vena yugular: resección obligatoria.
- Arteria carotidea superficial: resecar la adventicia.
- Arteria carotidea masiva, reemplazo carotideo.
Los niveles del cuello en los cuales se encuentran los ganglios linfáticos son:

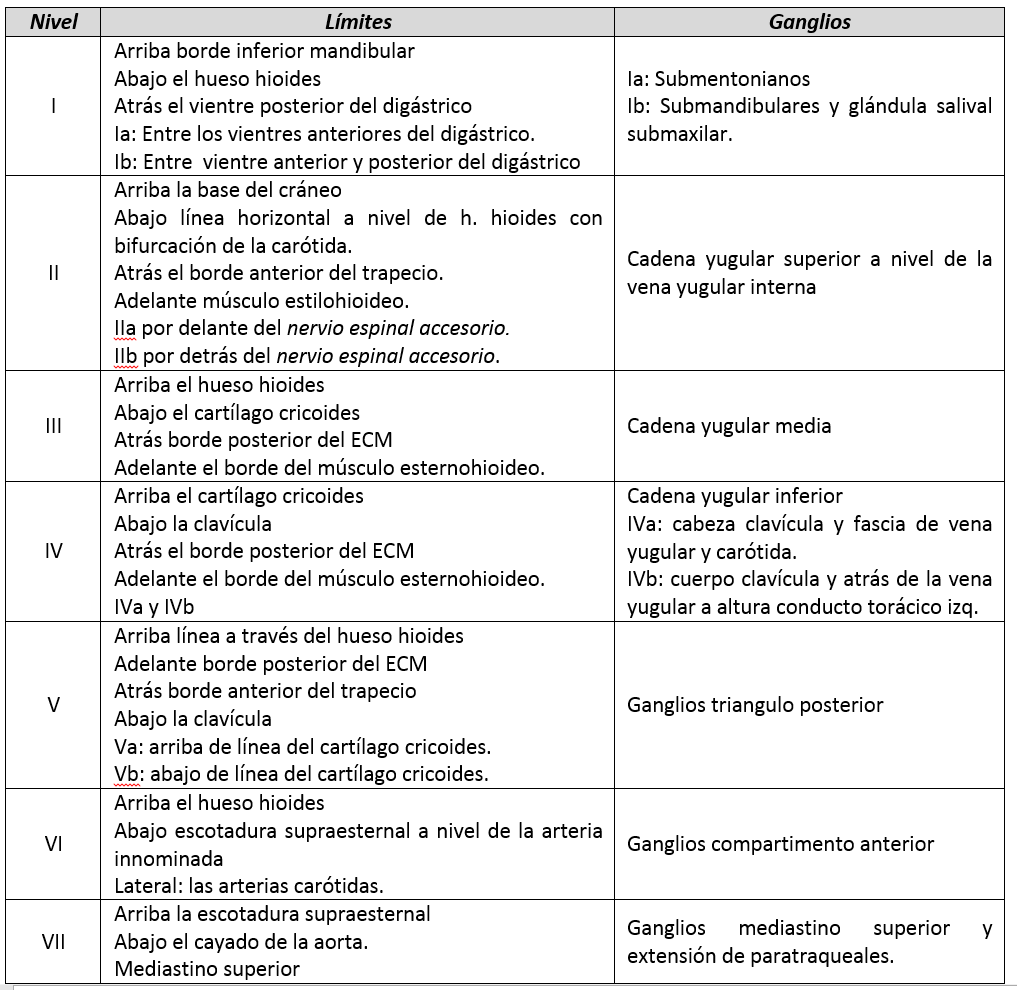
Los ganglios cervicales que más se afectan con metástasis en los CDT son los del nivel VI (compartimento central) y nivel VII que corresponde a la clasificación TNM a los N1a, encontrándose que del 20 al 60% de los CDT sin compromiso ganglionar evidente presentan micrometástasis en este nivel; luego los siguientes ganglios más afectado se localizan en el nivel III y IV (compartimento lateral).
4).- Estadificación postoperatoria inicial (estática):
Luego del tratamiento quirúrgico, se debe realizar en las primeras semanas o meses la estatificación para:
.- Predecir la supervivencia del paciente.
.- Estimar el riesgo de persistencia o recurrencia (recidiva) de la enfermedad.
.- Definir la necesidad o no de realizar ablación con IRA.
Esta estadificación inicial es estáticas o sea no cambian con el tiempo y se realizan de acuerdo a 4 criterios:
- Hallazgos histo-patológicos preoperatorios y operatorios.
- Hallazgos quirúrgicos.
- Hallazgos bioquímicos (TG y AbTG).
- Imágenes de cuello posterior al tratamiento quirúrgico.
a).- Clasificaciones para predecir la supervivencia:
Existen muchas escalas para predecir la supervivencia (o conocer la mortalidad o riesgo de muerte por enfermedad, hablando en términos negativos) entre las que tenemos:
- EORTC: Organización Europea para la Investigación sobre el Tratamiento del Cáncer;
- EDADES: edad del paciente, grado histológico del tumor, extensión del tumor (invasión extratiroidea o metástasis a distancia) y tamaño del tumor primario;
- AMES: edad del paciente, presencia de metástasis a distancia, extensión y tamaño del tumor primario;
- MACIS: metástasis, edad del paciente, compleción de la resección, invasión local y tamaño del tumor;
- OSU: Universidad Estatal de Ohio;
- MSKCC: Memorial Sloan-Kettering Cancer Center;
- NTCTCS: Estudio cooperativo nacional para el tratamiento del cáncer de tiroides;
- TNM: American Joint Committee on Cancer y la Unión Internacional para el Control del Cáncer (AJCC/UICC) o sistema de estadificación del tamaño del tumor (T), metástasis nodales (N) y metástasis a distancia (M).
En esta revisión describiremos la clasificación TNM de la AJCC.
b).- Estadificación estática para establecer riesgo de persistencia o recurrencia (recidiva) de la enfermedad y necesidad de ablación con RAI.
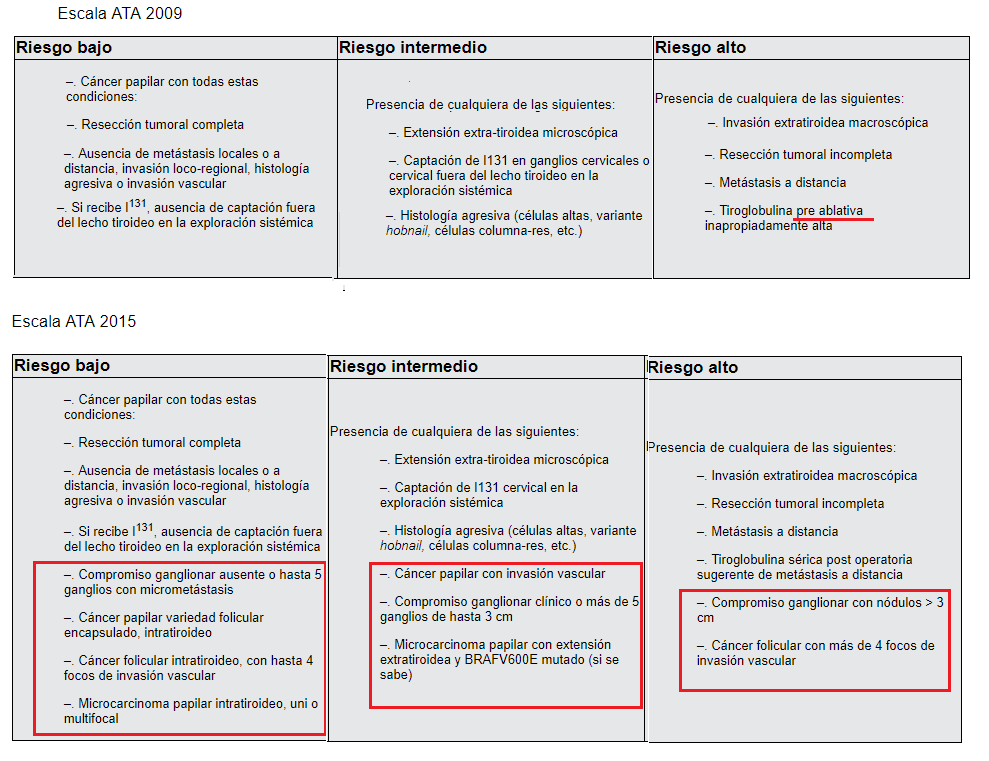
La estadificación que describiremos en esta revisión es el Sistema Estratificado de Riesgo Modificado del año 2009 de la ATA (SERM ATA 2009), el cual fue modificado en el año 2014-2015.
CLASIFICACIÓN TNM DEL CDT AJCC/UICC 8 edición (2.017 que entró en vigencia en enero/2018).
American Joint Committee On Cancer / International Union against Cancer).
Este sistema de clasificación es postoperatorio y se usa para estratificar el riesgo de mortalidad, siendo débil para establecer el riesgo de recurrencia.
- T: Tumor primario (TP)
- T0: Tumor primario no evidente
- Tx: Tumor primario no evaluable
- T1: TP ≤ 2 cm intratiroidéo.
- T1a: TP ≤ 1 cm intratiroidéo
- T1b: TP > 1 cm a ≤ 2 cm intratiroidéo.
- T2: TP de > 2 a ≤ 4 cm intratiroidéo.
- T3: TP > 4 cm
- T3a: TP > 4 cm intratiroidéo
- T3b: TP de cualquier tamaño con extensión extratiroidea que invade tejido peritiroideo o a los músculos omohioideo, esternohioideo, tirohioideo, o externotiroideo.
- T4a: Invasión extracapsular a laringe, tráquea, esófago, nervio recurrente laríngeo o tejido subcutáneo
- T4b: Invasión extracapsular que involucra fascia prevertebral o arteria carótida o vasos mediastinales.
- N: Nódulos o ganglios linfáticos (GL) regionales.
- N0: GL regionales sin metástasis.
- N0a: Uno o más ganglios linfáticos benignos confirmados histo-citológicamente.
- N0B: No evidencia clínica ni radiológica de metástasis a ganglios linfáticos locorregionales.
- Nx: GL regionales no evaluables.
- N1a: Metástasis a GLR localizados en el nivel VI (prelaringeos, pretraqueales y paratraqueales) o VII (mediastínicos superiores), unilaterales o bilaterales.
- N1b: Metástasis a GLR unilateral, bilateral o contralateral (niveles I, II, III, IV o V) o GL retrofaríngeos.
- M: Metástasis a distancia.
- M0: No M a distancia.
- M1: M a distancia.
NOTA 1: Esta clasificación TNM se puede aplicar al CMT, llamando la atención que un tumor T4a es llamado “enfermedad moderadamente avanzada” y el tumor T4b es llamado “enfermedad muy avanzada”.
NOTA 2: Esta clasificación TNM se puede aplicar al CAT, llamando la atención que en los canceres indiferenciados de tiroides (como también se les llama a los CAT), no tiene importancia el tamaño del tumor, sino solamente si tiene extensión extratiroidea o no, por eso todos son T4.

ESTADIFICACIÓN DEL CDT POR GRUPOS SEGÚN EL TUMOR (TNM) Y EDAD PARA ESTABLECER PRONOSTICO DE SOBREVIVENCIA A 10 AÑOS.
1).- Estados del CDT en menores de 55 años.
.- Estadio I: Cualquier T + Cualquier N + M0
.- Estadio II: Cualquier T + Cualquier N + M1
2).- Estados del CDT en pacientes de 55 o más años.
.- Estadio I: T1 + N0/Nx + M0
T2 + N0/Nx + M0
.- Estadio II: T1 + N1 + M0
T2 + N1 + M0
T3 + cualquier N + M0
.- Estadio III: T4a + cualquier N + M0
.- Estadio IVa T4b + cualquier N + M0
.- Estadio IVb: Cualquier T + cualquier N + M1
PRONOSTICO DE SUPERVIVENCIA DEL CDT A 10 AÑOS DE ACUERDO A LA ESTADIFICACIÓN TNM Y POR EDAD:
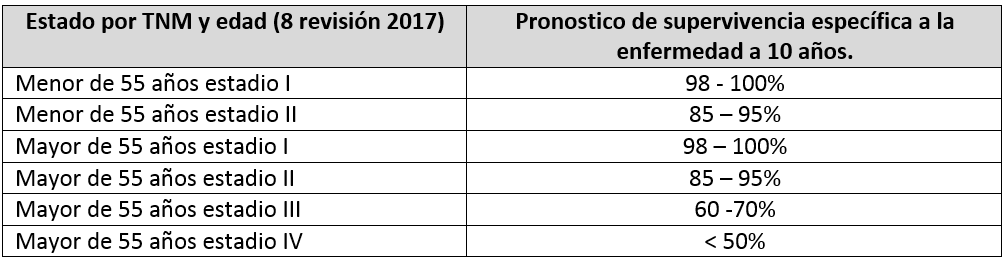
NOTAS ACLARATORIAS DE LA ACTUALIZACIÓN DE LA 8 REVISIÓN 2017 DE LA CLASIFICACIÓN TNM que entró en vigencia en 1 enero 2018:
- En T3 se eliminaron las metástasis regionales de los ganglios linfáticos y la extensión extratiroidea microscópica.
- T3a es una nueva categoría para tumores> 4 cm confinada a la glándula tiroides
- T3b es una nueva categoría para tumores de cualquier tamaño con extensión extratiroidea a músculos peritiroideos.
- Se incluyeron los ganglios linfáticos de nivel VII en N1a (antes se encontraban en N1b)
- La presencia de metástasis a distancia en pacientes mayores se clasifica como IVb, antes se clasificaba como IVc.
- Se elevó la edad de corte al momento del diagnóstico 45 a 55 años.
- La nueva clasificación clasifica menos pacientes en estadios III o IV, pero le establece peor pronóstico a los que quedan en esos niveles.
SISTEMA DE ESTADIFICACIÓN DE RIESGO MODIFICADO DE LA ATA 2009 (SERM ATA 2009) DEL RIESGO DE PERSISTENCIA O RECURRENICA DE ENFERMEDAD (MODIFICADO POR ATA 2015).
Este sistema clasifica el riesgo de recurrencia y de persistencia en las primeras semanas a meses luego del tratamiento inicial, pudiéndose realizar entre los 6 a los 18 meses luego del tratamiento inicial, sin embargo lo ideal es realizarlo en los primeros 6 meses (para poder luego realizar la estadificación dinámica, más adelante presentada).
Persistencia: Cuando luego del tratamiento inicial no se dan los criterios para remisión de la enfermedad o sea el paciente nunca ha estado libre de la enfermedad.
Recurrencia o recidiva: Se define como el fracaso del primer tratamiento pero no es exclusivamente por un mal tratamiento sino que también puede ser por un buen tratamiento pero que el tumor no respondió adecuadamente y para que se presente el paciente debe presentar inicialmente criterios de remisión para estar libre de enfermedad y luego aparece nuevamente la enfermedad.
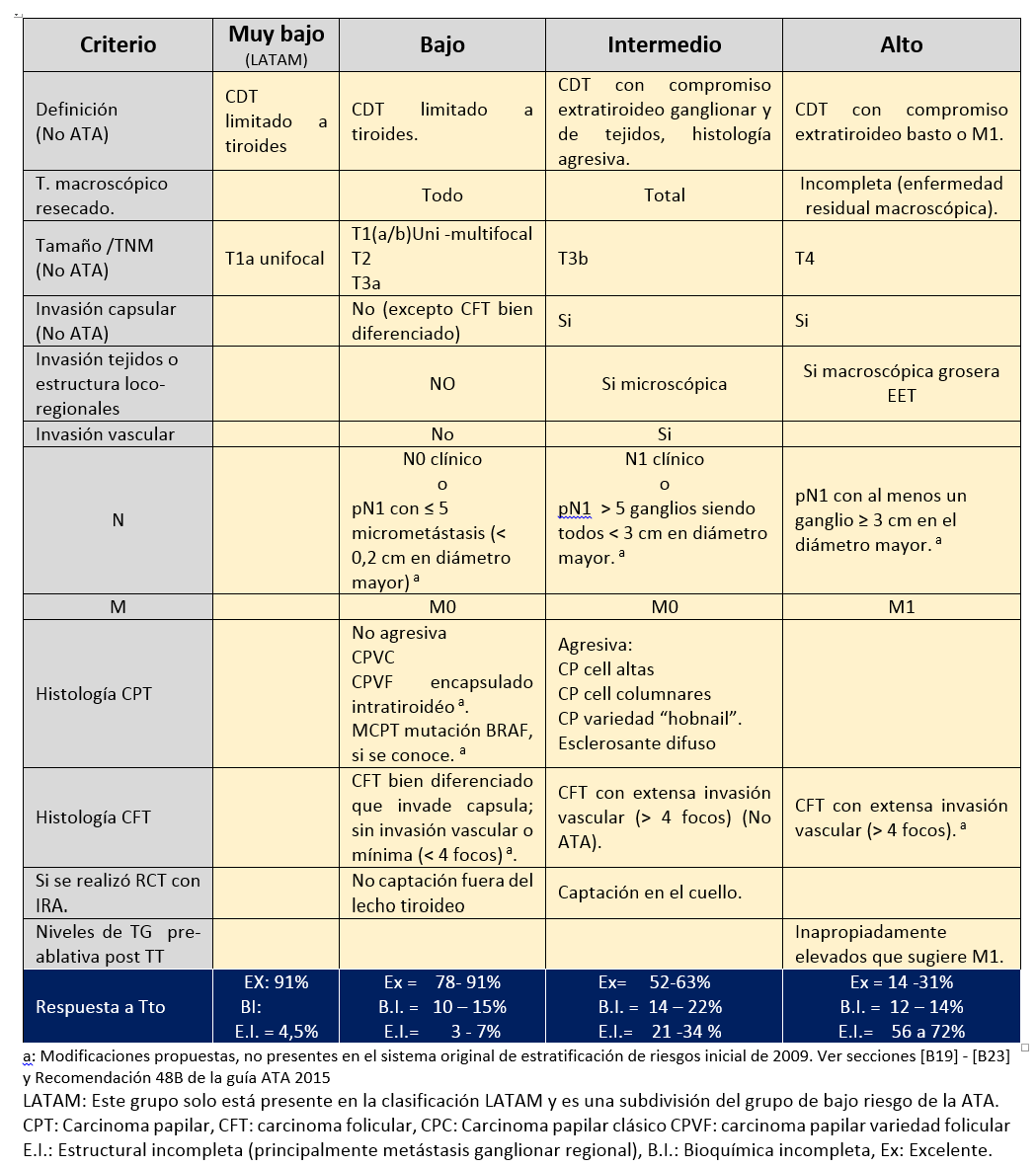
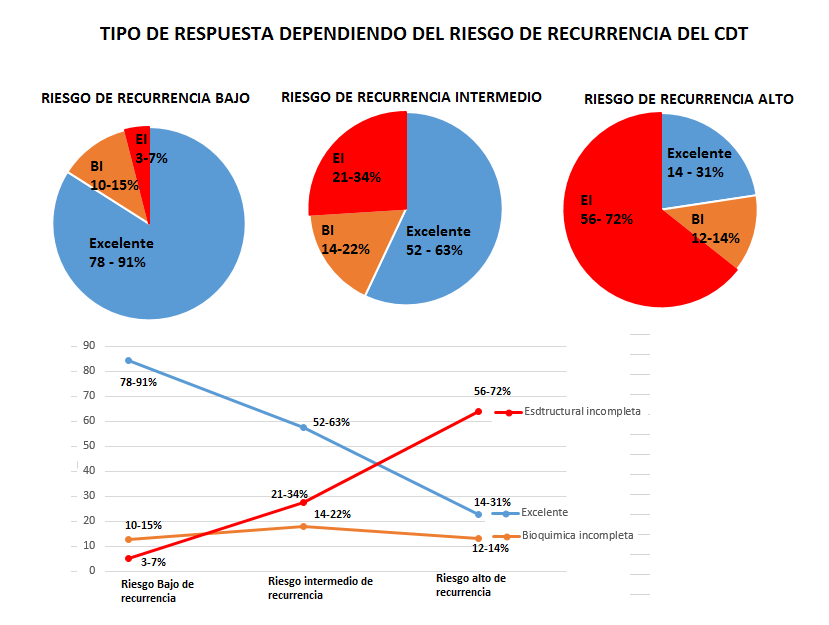
Con el fin de evaluar las modificaciones incluidas en al año 2015 a la estadificación del riesgo de recurrencia del año 2009 de la ATA, se resumen en el siguiente cuadro:
5).- Tratamiento supresor de la TSH con L-T4 postoperatorio:
La TSH estimula la proliferación de tirocitos normales y también de las células del cáncer de tiroides, por eso debe suprimirse con L-T4 (no está claro este beneficio: Sugitani I, Fujimoto Y. Does postoperative thyrotropin suppression therapy truly decrease recurrence in papillary thyroid carcinoma? A randomized controlled trial. J Clin Endocrinol Metab; 95:457683, 2010).
En caso de TT el tratamiento con T4 no solo es supresor de la TSH, sino de reemplazo hormonal para evitar el hipotiroidismo secundario.
En caso que no esté indicada la ablación con IRA o deba posponerse, se debe iniciar la supresión de la TSH o el reemplazo hormonal, en el postoperatorio inmediato (en las primeras 72 horas posquirúrgicas) a dosis plenas de 1 a 1,5 mcg/Kg día, en los siguientes casos:
- TP < 1 cm y sin adenopatías ecográfica prequirúrgica en quienes se considera que no recibirán IRA,
- Paciente con contraindicación de IRA (embarazo, lactancia);
- En los que se decidirá si la ablación contra histopatología quirúrgica y este sea demorado.
- Paciente con indicación de ablación que recibirán con rhTSH;
- Pacientes expuestos a sobrecarga de yodo orgánico (amiodarona, medio de contraste iodado).
Las metas de supresión TSH dependen del riesgo de recurrencia y de la respuesta al tratamiento de TT + IRA ablativo, de la siguiente forma:
.- Metas de supresión de la TSH durante la terapia inicial (2 primeros años) es:
- Riesgo muy bajo: > 0,5 a 2 mUI/L.
- Riesgo bajo: 0.1 a 0.5 mUI/L.
- Riesgo alto e intermedio: < 0,1 mUI/L.
.- Metas de supresión de la TSH durante el seguimiento (luego de 2 años) en paciente con remisión:
- Riesgo bajo y muy bajo: 0.1 a 2 mUI/L.
- Riesgo alto e intermedio: < 0,1 mUI/L mantenerla por 3 a 5 años.
.- Metas de supresión de la TSH durante el seguimiento (luego de 2 años) en pacientes con persistencia bioquímica o estructural: Mantener suprimida.
Sin embargo este “hipertiroidismo subclínico” inducido por L-T4 debe ser valorado costo-beneficio sus efectos adversos en pacientes que presentan riesgo así:
.- Paciente con enfermedad cardiovascular:
- Antecedente de EC: puede causar angina,
- Cardiópatas y edad avanzada puede causar arritmias (FA y otras), ICC, dilatación auricular.
.- Paciente con antecedente de ECV.
.- Posmenopáusicas aumenta la osteoporosis.
Si se requiere realizar rastreo corporal total (RCT) con 131-I o administrar 131-I para Tto ablativo se debe suspender la L-T4 entre 3 a 4 semanas antes, con el fin de aumentar la avidez de las células tumorales malignas por el 131-I. Otra opción es reemplazar la L-T4 por liotironina por 2 a 4 semanas y suspendiéndola 2 semanas antes o administrando TSH recombinantes (rhTSH) previo al RCT.
6).- Radioyodo (RAI) como tratamiento ablativo, adyuvante y terapéutico:
Luego de la TT puede requerirse IRA (131-I) con una de las siguientes indicaciones:
a).- Ablativo: para eliminar remantes tiroideos normales.
b).- Adyuvante: para eliminar micrometástasis sospechadas pero no confirmadas.
c).- Terapéutico: para tratar enfermedad persistente conocida.
6.1).- RAI ablativo:
Objetivo de la ablación con RAI:
La eliminación de los remantes tiroideos normales luego de TT tiene por objetivo:
- Dar especificidad a la TG como marcador tumoral.
- Dar especificidad al rastreo corporal total (RCT) con 131-I, cuando esté indicado.
Se requiere E tanto de la TG como del RCT con el fin de detectar tempranamente la enfermedad persistente o recurrente.
La indicación y dosis de la ablación con RAI.
Depende de la clasificación del riesgo de recurrencia y persistencia de la enfermedad así:
Categoría I (muy bajo riesgo): No indicado:
.- T1a unifocal o multifocal.
.- CONTRAINDICADO en T1a (MCPT unifocal).
Categoría II (bajo riesgo): Indicación no absoluta (para optimizar el seguimiento).
.- Dosis 30 mCi.
Categoría III (riesgo intermedio): Debe considerarse la indicación.
.- Dosis: 100 mCi (con rango de 30 a 150 mCi, usando la menor dosis posible).
.- Dosis máxima de 150 mCi solo en caso de histología agresiva de CPT y en invasión vascular en CFT.
Categoría IV (alto riesgo): Indicación absoluta.
.- Dosis: 150 mCi (con rango de 150 a 200 mCi).
.- En esta categoría por existir extensión extratiroidea y existir el riesgo de remanente posquirúrgico se recomienda antes de aplicar la ablación con RAI realizar una GMG.
Efectos secundarios de la ablación con RAI:
Son efectos secundarios dosis dependiente (no estocásticos o no probabilísticos o deterministas):
- Disfunción de las glándulas salivales.
- Náuseas.
- Dolor cervical.
Técnica y preparación del paciente para la ablación con RAI.
Para llevar a cabo la ablación el paciente debe poseer niveles de TSH elevados (para que estimulen los tirocitos a captar el RAI), lo cual se pude lograr mediante la administración de TSH recombinante o tirotropina alfa (rhTSH) o induciendo un estado de hipotiroidismo mediante la suspendiendo la L-T4.
.- Uso de rhTSH:
- Dosis de rhTSH: 0.9 mg/día (1 ampolla/día) IM por dos días sucesivos previo a dosis de 131-I, que se administra al 3 día (y luego entre el día 5 y 8 luego a la administración del 131-I ablativo se realiza un rastreo corporal total postablación).
- La ventaja del uso de rhTSH sobre el estado de hipotiroidismo inducido es el no someter el paciente a los síntomas del hipotiroidismo (mejor calidad de vida por mantener normal la actividad mental, física y emocional).
- Contraindicación de rhTSH: en evidencia clínica y/o por imágenes de M1, por eso no se encuentra aprobada por la FDA para uso en pacientes con riesgo de recurrencia intermedio o alto.
.- Inducción de estado de hipotiroidismo:
- Debe ser por el menor tiempo posible (alrededor de 25 días) con el fin de lograr valores recomendados de TSH mínimo de 30 mUI/L, siendo un valor ideal de 40 mUI/L.
- Previo a la ablación por método de inducción de hipotiroidismo se debe medir niveles de TG y AbTG, considerándose valores inferiores a 10 ng/ml de TG como de un alto VPN, siendo un criterio de bajo riesgo de recurrencia.
- Un falso negativo de TG (indetectable) se presenta cuando en la anatomía patológica se asocia una Tiroiditis de Hashimoto, por interferencia en la medición por presencia de AbTG.
- El reinicio de la L-T4 luego de la dosis de RAI debe ser de mínimo 2 días después.
.- Preparación del paciente para la ablación con RAI:
La eficiencia de la ablación depende de la dosis efectivamente captada por el tejido tiroideo normal remanente, por eso se debe:
- Evitar consumo de alimentos con alto contenido de yodo 20 días antes de la terapia y hasta 2 días luego de la terapia ablativa (sal yoda consumiendo los alimentos sin sal, pescados, mariscos, frutos secos, repollo, rábanos, lácteos, huevo, hojas verdes).
- No consumo de multivitamínicos que contengan yodo (aceite hígado de bacalao etc).
- No uso de medios de contraste radiológicos yodados hidrosolubles no iónico, en este caso debe diferirse la ablación mínimo 1 mes (ideal 2 meses).
- No uso de antisépticos con yodo, en dado caso retrasara la terapia 1 semana.
- Debe suspenderse los siguientes medicamentos con la siguiente anterioridad:
- Levotiroxina 25 días antes.
- Corticoides 1 semana.
- Nitratos 1 semana.
- Mercuriales 1 semana.
- Amiodarona 6 a 12 meses.
6.2).- RAI como tratamiento:
Indicación del RAI como tratamiento:
.- La indicación es en caso de M1 conocidas (enfermedad persistente),
.- Que el tumor no sea RAI refractario (ver tumores radiorefractarios, adelante).
Dosis del RAI como tratamiento:
.- Dosis recomendada es de 200 mCi.
.- La dosis terapéutica de RAI (200 mCi) debe ser manejada con precaución en pacientes añosos, falla renal o metástasis sistémicas, por lo cual se recomienda docimetría.
.- Cuando se usa como RAI terapéutico en M1 potencialmente peligrosas como es el caso del SNC, médula espinal o cercanía a vías respiratorias, requiere el uso de corticoides previamente y en lo posible hospitalizar al paciente por cuanto se pueden presentar complicaciones agudas tales como:
- Agravamiento de cuadros neurológicos.
- Edema,
- Sangrado.
Los niveles de TG no son criterios de crecimiento tumoral (sino de pronóstico de sobrevida) por lo que el aumento de los niveles no indica incremento del tamaño de tumoral y por tanto no puede usarse para calificar la eficiencia del RAI.
7).- Seguimiento al tratamiento del CDT con TT con o sin ablación con RAI de acuerdo al riesgo de recurrencia o persistencia de enfermedad:
Los estudios solicitados para el seguimiento dependen del riesgo de R y P así:
.- Riesgo de recurrencia y persistencia bajo:
- TG bajo tratamiento con L-T4, sin requerirse la toma de TG estimulada.
- AbTG.
- US de cuello.
.- Riesgo de recurrencia y persistencia intermedio:
- TG bajo tratamiento con L-T4 o puede tomarse la TG estimulada.
- AbTG.
- US de cuello.
- RCT con 131-I
.- Riesgo de recurrencia y persistencia alto:
- TG bajo tratamiento con L-T4 o puede tomarse la TG estimulada.
- AbTG
- US de cuello.
- RCT con 131-I.
- Otras imágenes como TC, IRM o PET-CT con 18FDG.
7.1).- Seguimiento con RCT con 131-I:
Indicaciones:
No es un estudio para seguimiento de rutina porque tiene baja sensibilidad y solo está indicado en:
.- Riesgo inicial de recurrencia y persistencia inicial postquirúrgico intermedio y alto.
.- Previo a la ablación con RAI está indicado (de acuerdo al consenso Argentino de Tiroides) en:
- Cuando la magnitud del remanente tiroideo normal no es claro, por la magnitud de la resección quirúrgica.
- Cuando hay sospecha de M1, con el fin de decidir si es ablación o terapéutico.
- La dosis del RCT previo da la ablación es de 0.1 a 1 mCi, para evitar el “atontamiento” de la célula tiroidea normal (recomendación 27 del consenso argentino).
.- Luego de 2 a 5 días luego de la ablactación con RAI, porque del 10 al 26% de los pacientes luego de la ablactación presentan focos de enfermedad, que cambian la estadificación inicial. Se recomienda realizarlo con SPECT-CT, con el fin de mejorar la localización anatómica (recomendación 28 consenso Argentino).
.- Cuando en un control de riesgo de recurrencia y persistencia dinámico se encuentre evidencia estructural o bioquímica de la enfermedad o sea que exista respuesta bioquímica o estructural incompleta.
7.2).- Seguimientos con TG y AbTG:
.- La TG es el mejor marcador tumoral del CDT específico cuando el tratamiento ha sido la TT + ablactación con RAI.
.- La mayoría de las células tumorales de los CDT sintetizan TG, aunque molecularmente tiene diferencias.
.- La presencia de TG luego de una TT + ablactación con RAI, indican una de estas 3 posibilidades:
- Remantes de tiroides normal que no fueron ablacionados totalmente.
- Persistencia del CDT o
- Recurrencia del CDT.
.- Niveles de TG se relacionan con la posibilidad de presencia de enfermedad estructural, así:
- Niveles de TG estimulada con rhTSH < 2 ng/ml, rara vez se presentan en persistencia o recurrencia de enfermedad.
- Niveles de TG estimulada con rhTSH > 2 ng/ml, se asocian con persistencia o recurrencia de enfermedad.
.- De acuerdo al riesgo de recurrencia estático inicial luego del tratamiento entre más alto el riesgo es menos probable una respuesta bioquímica incompleta (es más probable la respuesta estructural incompleta).
.- Se define respuesta bioquímica incompleta (en la estadificación dinámica del riesgo de R y P) como niveles elevados de TG sea suprimida o estimulada sin evidencia de lesión estructural en US u otras imágenes.
.- Presencia de AbTG indica que hay producción de TG (lo cual estimula la producción de los AbTG).
.- Los AbTG interfiere con los niveles de TG (disminuyéndolos).
Fuente: Biochemical persistence in thyroid cancer: is there anything to worry about? Pitoia Fabian, Bueno Fernanda, Cross Graciela, Abelleira Erika, Urciuoli Carolina, Tala Hernan. 19 October 2013 DOI 10.1007/s12020-013-0097-6
7.3).- Seguimiento con otras imágenes diferentes a US de cuello:
Están indicadas en:
.- En CFT debido a que se diseminan rápidamente hematógena a pulmón y hueso (además de SNC).
.- Riesgo inicial postquirúrgico de recurrencia y persistencia alto.
.- Cuando en las evaluaciones dinámicas del riesgo de recurrencia y persistencia se encuentre:
- TG elevada con supresión.
- En caso de TG elevada con RCT negativo, se debe buscar enfermedad residual o metástasis con otras imágenes como TC, IRM o PET (El PET con 18-FDG es útil en caso de elevación de TG o AbTG). Dependiendo la localización de la enfermedad residual o metástasis se puede realizar reintervención Qx o Rt o Qt (menor eficacia).
8).- Re-estadificación durante el seguimiento o estadificación dinámica del riesgo y respuesta al tratamiento:
La estadificación inicial del riesgo postratamiento inmediato de persistencia o recurrencia del CDT realizado mediante los criterios del Sistema Estratificado de Riego de Persistencia y Recurrencia ATA 2009 modificados 2015, debe modificarse en forma activa de acuerdo a la información que se va obteniendo mediante el seguimiento reflejando una respuesta individualizada del paciente al tratamiento o sea una evaluación dinámica del riesgo de persistencia o recurrencia de la enfermedad.
El objetivo del seguimiento al tratamiento de CDT depende del riesgo de recurrencia inicialmente calculado, así:
- Riesgo de recurrencia muy bajo y bajo: confirmar la ausencia de enfermedad.
- Riesgo intermedio y alto: detectar a tiempo la persistencia o recidiva de la enfermedad.
La estadificación dinámica del riesgo de recurrencia o persistencia del CDT se inicia mínimo entre los 3 meses siguientes al tratamiento con TT con o sin ablación con RAI y máximo hasta los 2 años después (lo ideal a los 6 meses postratamiento), lo cual se realiza en cada visita de control que se le realice al paciente, siendo que entre más bajo el riesgo de recurrencia es mejor realizar la evaluación inicial más tardíamente de tal forma que para los de alto riesgo de recurrencia se estadificación dinámica se puede realizar entre los 3 a los 6 meses, pero para los de muy bajo riesgo es mejor diferirlo hasta los 2 años, realizándose en cada visita de seguimiento reclasificación según uno de los siguientes resultados clínicos:
- Respuesta excelente: no hay evidencia clínica, bioquímica o estructural de enfermedad.
- Respuesta bioquímica incompleta: valores anormales de AbTG o TG en ausencia de enfermedad estructural evidenciable.
- Respuesta estructural incompleta: enfermedad locorregional persistente o nueva o metástasis a distancia.
- Respuesta indeterminada: hallazgos bioquímicos o estructurales inespecíficos que no se pueden clasificar con confianza como benignos o malignos.
Los criterios para clasificar la respuesta al tratamiento de acuerdo a la estadificación dinámica del riesgo, depende del tratamiento recibido sea TT + IRA ablativo o TT solamente o lobectomía / istmolobectomía.
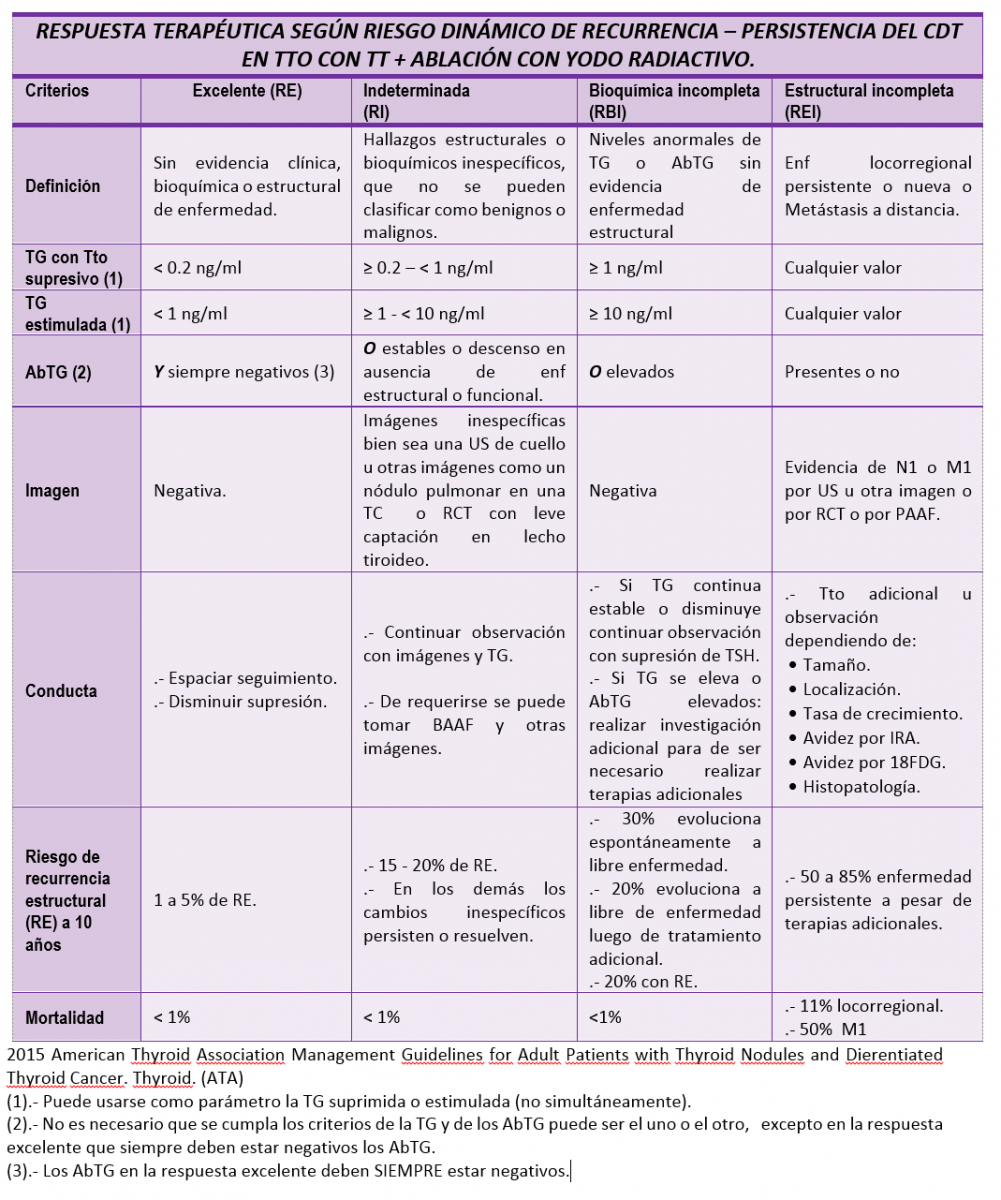
Las diferencias de parámetros para definir la respuesta al tratamiento de acuerdo al riesgo de recurrencia dinámico en pacientes que recibieron TT SIN IRA ABLATIVO son:
.- Respuesta excelente en Tto con TT sin IRA ablativo:
- Valor de TG estimulada < 2 ng/ml (en Tto ablativo con IRA es < 1 ng/ml).
- Resto igual.
.- Respuesta indeterminada en Tto con TT sin IRA ablativo:
- Valor de TG no estimulada ≥ 0,2 – 5 ng/ml (en Tto ablativo con IRA es ≥ 0,2 – 1 ng/ml).
- Valor de TG estimulada ≥ 2 – 10 ng/ml (en Tto ablativo con IRA es ≥ 1 – 10 ng/ml).
- Resto igual.
.- Respuesta bioquímica incompleta en Tto con TT sin IRA ablativo:
- Valor de TG no estimulada > 5 ng/ml (en Tto ablativo con IRA es > 1 ng/ml).
- También puede encontrarse elevaciones de la TG con aumento de TSH similares.
- Resto igual
.- Respuesta estructural incompleta en Tto con TT sin IRA ablativo:
- No hay diferencia en criterios al Tto de TT con ablación con IRA.
Las diferencias de parámetros para definir la respuesta al tratamiento de acuerdo al riesgo de recurrencia dinámico en pacientes que recibieron lobectomía o istmolobectomía son:
.- Respuesta excelente en Tto de lobectomía o istmolobectomía:
- Valor de TG NO estimulada < 30 ng/ml (en Tto ablativo con IRA es < 0.2 ng/ml), porque lógicamente existe la mitad del tiroides que produce TG y se esperan valores del 50% de la TG que produce una glándula intacta.
- TG estimulada no se mide, por la misma razón anterior.
- Resto igual.
.- Respuesta indeterminada en Tto de lobectomía o istmolobectomía:
- Valores de TG no se miden, por la misma razón anterior.
- No se hace RCT, por la misma razón.
- Solo se hacen imagen diferente al RCT y se mide AbTG, con parámetros iguales.
.- Respuesta bioquímica incompleta en Tto de lobectomía o istmolobectomía:
- Valor de TG no estimulada > 30 ng/ml (en Tto ablativo con IRA es > 1 ng/ml).
- También puede encontrarse elevaciones de la TG con aumento de TSH similares.
- Resto igual.
.- Respuesta estructural incompleta en Tto de lobectomía o istmolobectomía:
- No hay diferencia en criterios al Tto de TT con ablación con IRA.
